大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
结直肠癌(colorectal cancer ,CRC)是全球最常见的癌症之一,转移性CRC患者的5年生存率低于20%。免疫检查点阻断(Immune checkpoint blockade,ICB)对CRC患者表现出良好疗效,然而只有一小部分高微卫星不稳定(MSI-H)或肿瘤错配修复缺失(dMMR)的患者对ICB响应。
N6-甲基腺苷(m6A)是最丰富的RNA修饰之一。m6A reader,如YTH N6-甲基腺苷RNA结合蛋白1/2/3(YTHDF1/2/3)、YTHDC1/2和IGF2BP1/2/3与m6A修饰的mRNA结合,以决定m6A修饰mRNA命运。YDHDF1、METTL3和ALKBH5等m6A调控因子已在癌症中得到深入研究。据报道,在各种癌症类型中,YTHDF1上调与癌症不良预后相关,YTHFD1可促进肿瘤发生和癌症转移。然而,YTHDF1在肿瘤免疫微环境(tumour immune microenvironment,TIME)中的作用尚不清楚。
2023年01月30日,香港中文大学医学院于君教授团队以“Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer”为题在《Gut》杂志发表研究论文,研究通过甲基化RNA免疫沉淀测序(MeRIP-seq)、RNA测序(RNA-seq)和核糖体测序(Ribo-seq)鉴定出YTHDF1的直接靶标,揭示YTHDF1通过m6A-p65-CXCL1/CXCR2轴抑制抗肿瘤免疫以促进CRC,可以作为免疫检查点阻断疗法的治疗靶点。

标题:Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer(靶向m6A reader YTHDF1可增强结直肠癌患者的抗肿瘤免疫并提高抗PD-1疗效)
时间:2023.01.30
期刊:Gut
影响因子:IF 31.793
技术平台:MeRIP-seq、RNA-seq、Ribo-seq、scRNA-seq等
研究摘要
N6-甲基腺苷(m6A)在肿瘤免疫微环境(TIME)中的作用尚不清楚。本研究通过在组织微阵列(N=408)和癌症基因组图谱(The Cancer Genome Atlas,TCGA) (N=526)队列中评估了YTHDF1的临床意义,在同基因肿瘤、肠道特异性YTHDF1敲入(knockin)小鼠和人源化小鼠模型中鉴定YTHDF1功能。研究利用单细胞RNA-seq (scRNA-seq)以分析TIME;采用MeRIP-seq、RNA-seq和Ribo-seq以鉴定YTHDF1直接靶点;囊泡样纳米颗粒(vesicle-like nanoparticles,VNPs)包封的YTHDF1-siRNA用于体内YTHDF1沉默。
研究结果表明,在TCGA-CRC中,YTHDF1表达与干扰素-γ基因标记呈负相关。在独立的组织微阵列队列中,YTHDF1蛋白与CD8+ T细胞浸润呈负相关,揭示了YTHDF1在TIME中的作用。在CT26(MSS-CRC)和MC38(MSI-H-CRC)同基因肿瘤中,YTHDF1基因缺失增强了抗肿瘤免疫,而在偶氮甲烷-葡聚糖硫酸钠(azoxymethane-dextran sulphate-sodium)或+ApcMin/+模型中,YTHDF1敲入促进了CRC的免疫抑制TIME。scRNA-seq鉴定出YTHDF1敲除肿瘤中髓源性抑制细胞(MDSC)减少,同时伴有细胞毒性T细胞增加。整合的MeRIP-seq、RNA-seq和Ribo-seq分析鉴定出p65/Rela是YTHDF1的靶点。YTHDF1通过促进p65翻译上调CXCL1,进而通过CXCL1-CXCR2轴促进MDSC迁移。增加的MSDC反过来在TIME中拮抗功能性CD8+ T细胞。另外,通过CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)或VNPs-siYTHDF1靶向YTHDF1增强了微卫星稳定(MSS)和高微卫星不稳定(MSI-H)模型中的抗PD1疗效,支持YTHDF1作为CRC免疫治疗的治疗靶点,阐明了YTHDF1在结直肠癌TIME中的功能和机制。
实验材料
临床样本:两个队列的石蜡样品用于建立组织微阵列(TMA)
队列Ⅰ:206例CRC患者的手术切除组织
队列Ⅱ:202例CRC患者的手术切除组织
人源化小鼠模型
肠道特异性Ythdf1敲入的小鼠CRC模型
TCGA数据
实验结果
(1)YTHDF1与结直肠癌IFN-γ相关基因标记减少和预后不良有关,单细胞转录组揭示YTHDF1诱导的免疫抑制
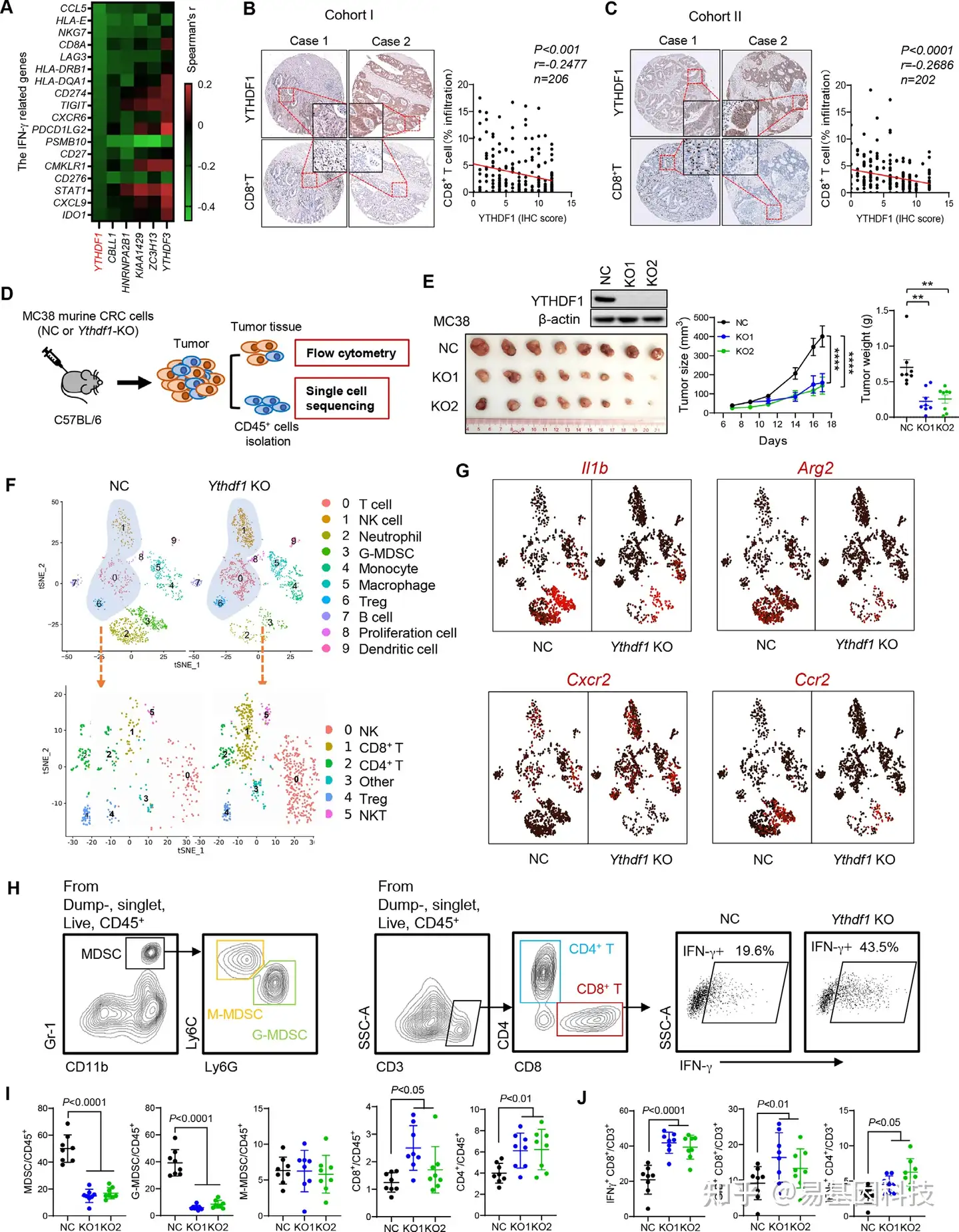
图1: YTHDF1与CRC患者的免疫抑制微环境相关,并通过免疫活性小鼠中进行scRNA-seq验证。
- TCGA数据集中干扰素-γ(IFN-γ)相关基因和m6A调控因子mRNA表达的Spearman相关性。
- 队列I中通过免疫组化染色鉴定YTHDF1蛋白水平与CD8+T细胞浸润的相关性(p<0.001,r=–0.2477,n=206)。
- 在队列II中进行验证(p<0.0001,r=−0.2686,n=202)。
- 通过FACS对有或没有YTHDF1敲除的肿瘤中分选出CD45+细胞进行单细胞分析的实验设计,随后进行scRNA-seq。NC:具有对照sgRNA的细胞。YTHDF1-KO:YTHDF1敲除的CRISPR细胞。
- C57BL/6小鼠中注射有或没有YTHDF1敲除的MC38同基因肿瘤的代表性图像(左)、肿瘤体积(中)和重量(右)。
- (上)tSNE图显示有或没有YTHDF1敲除的MC38同基因肿瘤中免疫细胞组分。(下)tSNE投影区域中显示的T细胞和NK细胞簇亚群分析。
- 所有细胞类型的标记标志物表达水平标记图,暗红色至亮红色表示低表达到高表达的表达水平。
- 流式细胞术的设门策略(Gating strategies)。髓源性抑制细胞(MDSC)、M-MDSC和G-MDSC的鉴定(左)。CD8+T和CD4+ T细胞的鉴定(中间)。显示(D)中YTHDF1-KO肿瘤中IFN-γCD8+ T细胞增加的代表性图像(右)。
- 对(D)中指定细胞的肿瘤进行流式细胞术分析(**p<0.01;***p<0.01)
(2)YTHDF1敲除可减少MDSC,但增加细胞毒性T细胞浸润
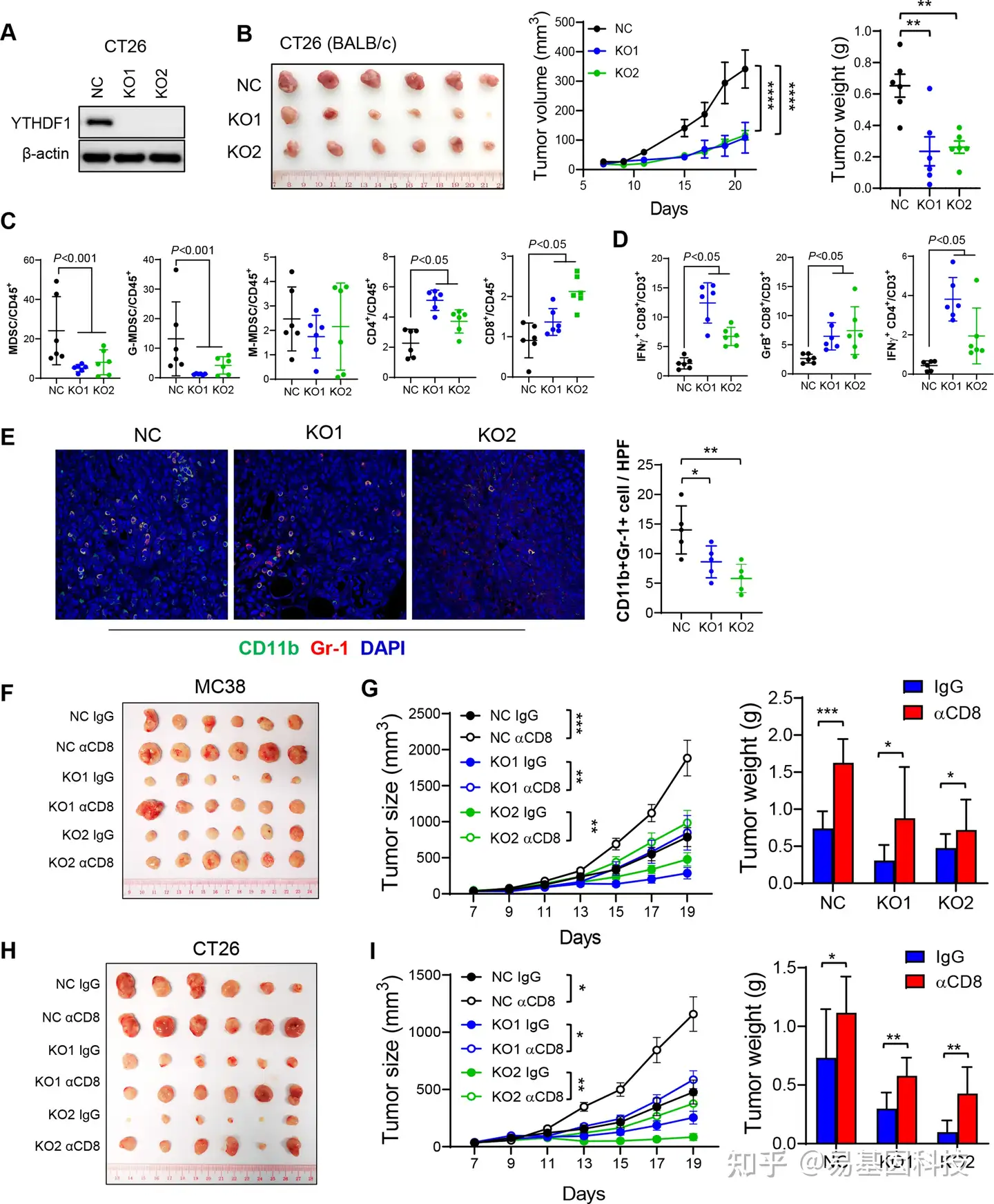
图2:YTHDF1敲除通过减少髓源性抑制细胞(MDSC)和增加同基因肿瘤中的功能性T细胞来诱导抗肿瘤免疫,但CD8+ T细胞缺失逆转了这种效应。
(3)肠道特异性YTHDF1敲入可以促进小鼠结直肠肿癌发生并抑制抗肿瘤免疫
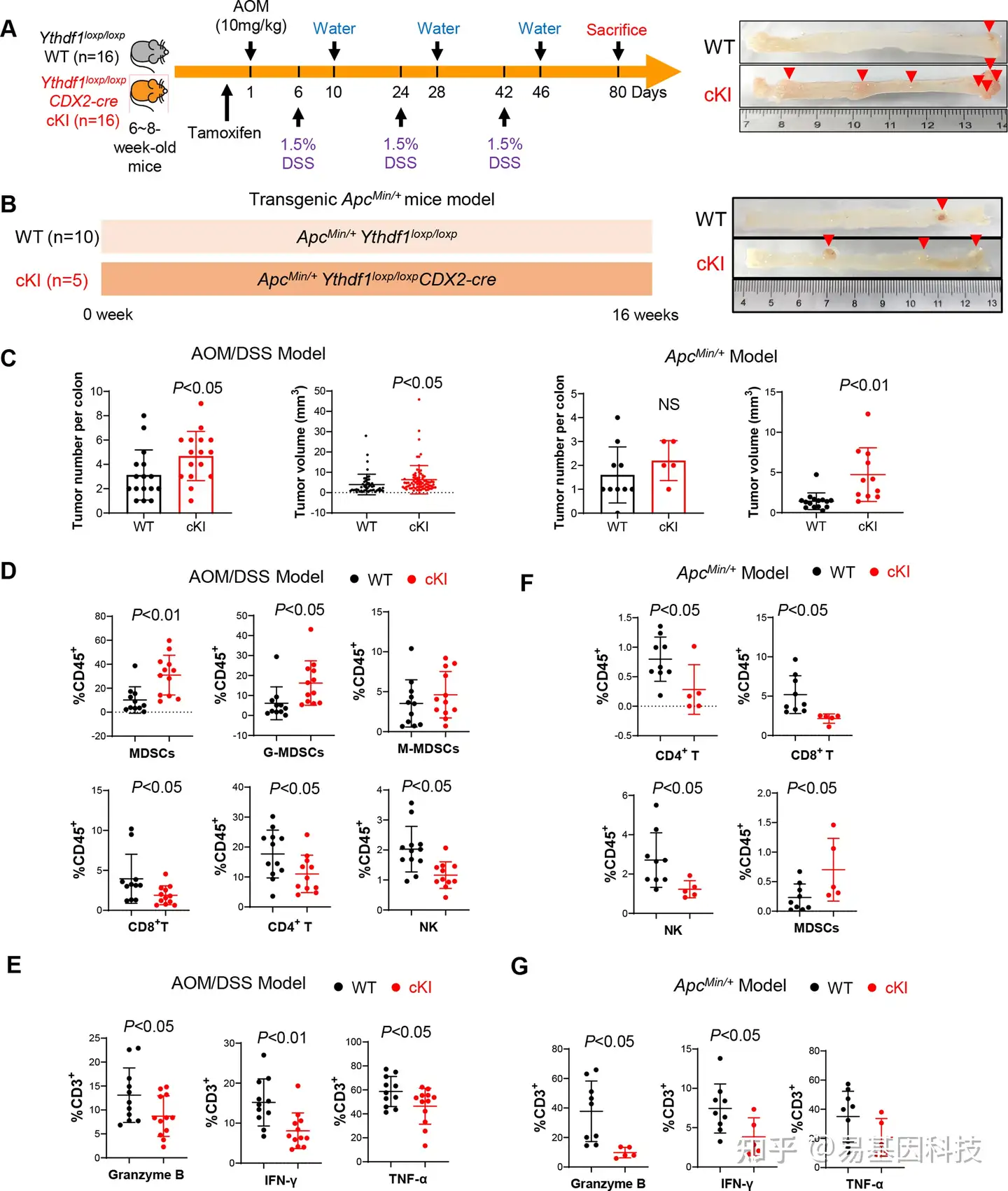
图3:肠道特异性YTHDF1敲入可以促进小鼠结直肠癌发生并抑制抗肿瘤免疫
(4)通过VNP-siYTHDF1靶向YTHDF1可以增强CD34+人源化小鼠模型的抗肿瘤免疫
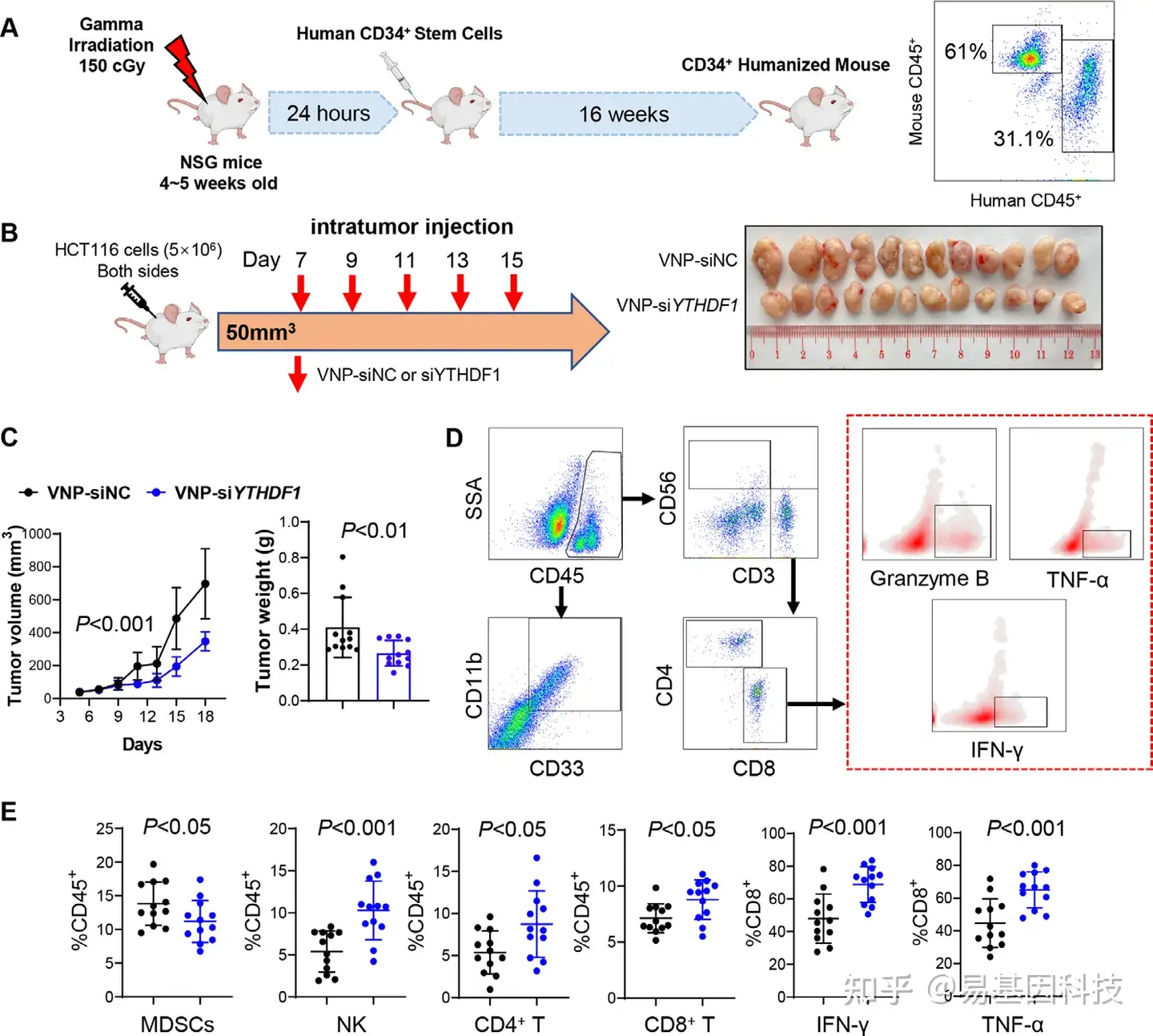
图4:VNP-siYTHDF1增强了CD34+人源化小鼠模型的抗肿瘤免疫力
(5)YTHDF1促进p65翻译以激活TNF-κB信号通路
为确定YTHDF1诱导免疫抑制的分子机制,研究人员在有或没有YTHDF1敲除的CRC细胞中进行了RNA-seq和Ribo-seq。通过RNA-seq分析,MC38-NC和MC38-YTHDF1-KO细胞间的差异表达基因在TNF和NF-κB信号通路中富集。并在另一种CRC细胞系CT26中获得了一致的结果,表明YTHDF1调控TNF-κB信号通路。同时通过qPCR验证了YTHDF1-KO降低了TNF-NF-κB靶点的mRNA表达。Ribo-seq数据表明,YTHDF1缺失与TNF信号通路失活显著相关,YTHDF1敲除降低了参与TNF信号的基因核糖体保护片段丰度(图5A)。因此,YTHDF1可以通过促进蛋白翻译来调节TNF-κB信号通路。由于YTHDF1的m6A reader功能,通过m6A免疫沉淀测序(MeRIP-seq)以鉴定m6A修饰的转录本。通过筛选参与TNF信号通路的mRNA m6A peaks,鉴定出两个p65 mRNA终止密码子周围的m6A位点(图5B),并通过MeRIP-qPCR进行验证(图5C)。通过RNA免疫沉淀(RIP)测序和抗YTHDF1抗体的RIP-qPCR鉴定出YTHDF1和p65 mRNA之间的直接互作(图5D)。因此,p65 mRNA是YTHDF1的直接靶点。另外,YTHDF1敲除可以降低CT26和MC38细胞中的p65蛋白表达,尤其是细胞核内的p65表达,但不影响NF-κB通路的其他调控因子(如IKKα和IκBα)的表达(图5E)。
值得注意的是,在YTHDF1-KO细胞中,p65的mRNA表达没有变化,支持YTHDF1主要在蛋白翻译水平上调节p65,这与已报道的YTHDF1促进其靶标翻译的功能一致。在人CRC细胞中获得了一致的结果,表明野生型YTHDF1过表达可以上调p65蛋白表达;而YTHDF1敲低会降低CRC细胞中的p65蛋白表达(图5F)。使用抗YTHDF1抗体的RIP-qPCR也证实了人CRC细胞中YTHDF1和p65 mRNA之间的直接互作(图5G)。体内验证YTHDF1和p65的相关性实验结果表明,在YTHDF1敲入小鼠中,CRC细胞中的p65和磷酸化p65蛋白均增加(图5H)。总之, YTHDF1促进p65蛋白表达,以激活体内和体外TNF和NF-κB信号通路。
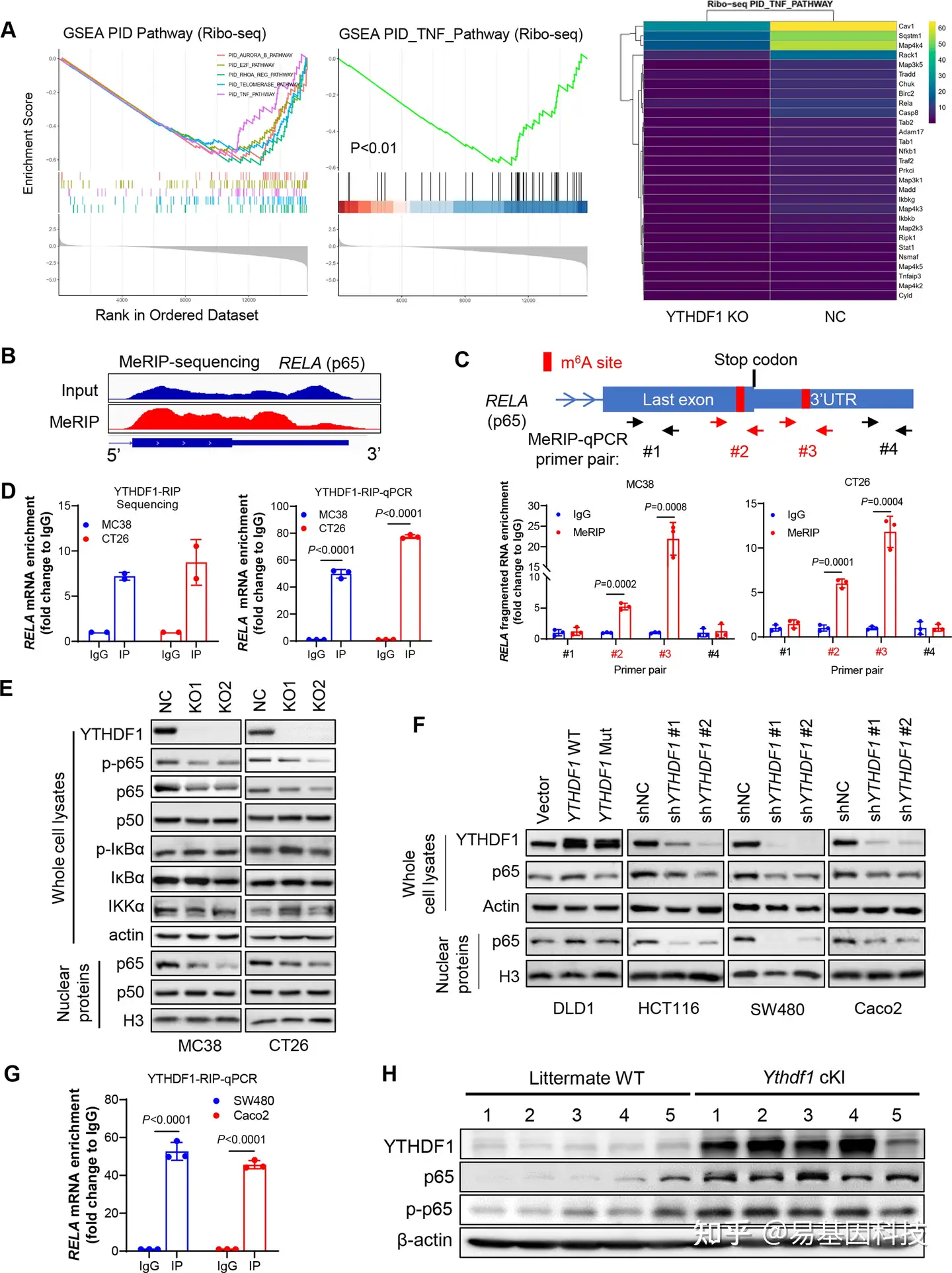
图5: YTHDF1通过促进RELA(p65)mRNA翻译以促进CRC TNF-κB信号通路。
- 有或没有YTHDF1敲除的CT26细胞之间的差异表达基因在Ribo-seq鉴定的TNF信号通路中富集(左)。TNF信号通路基因热图(右)。
- CT26细胞的MeRIP-seq测序分析结果表明RELA(p65)mRNA的最后一个外显子(last exon)或3’UTR上的m6A修饰。
- 设计MeRIP-qPCR引物以验证p65 mRNA上的m6A修饰。潜在的m6A位点以红色标出(上),MeRIP-qPCR引物用箭头表示。MeRIP-qPCR用引物#2和#3(较低)验证了m6A修饰。
- YTHDF1-RIP测序分析结果表明,与IgG对照相比,p65 mRNA富集(左)。YTHDF1-RIP-qPCR的小鼠p65 mRNA特异性引物(右)。
- YTHDF1敲除的TNF/NF-κB信号通路关键效应因子的Western blot分析。
- 用过表达野生型(WT)或突变型(mut)YTHDF1或用shRNA敲低YTHDF1的人CRC细胞进行的Western blot分析。非靶向shRNA(shNC)作为对照。
- YTHDF1-RIP-qPCR,与人p65 mRNA的特异性引物。
- 肠道特异性YTHDF1敲入小鼠和野生型同窝小鼠的结直肠癌细胞p65和磷酸化p65的表达Western blot分析,cKI:条件敲入(双尾t检验(C,D,G))。
(6)YTHDF1通过p65-CXCL1轴促进MDSC迁移
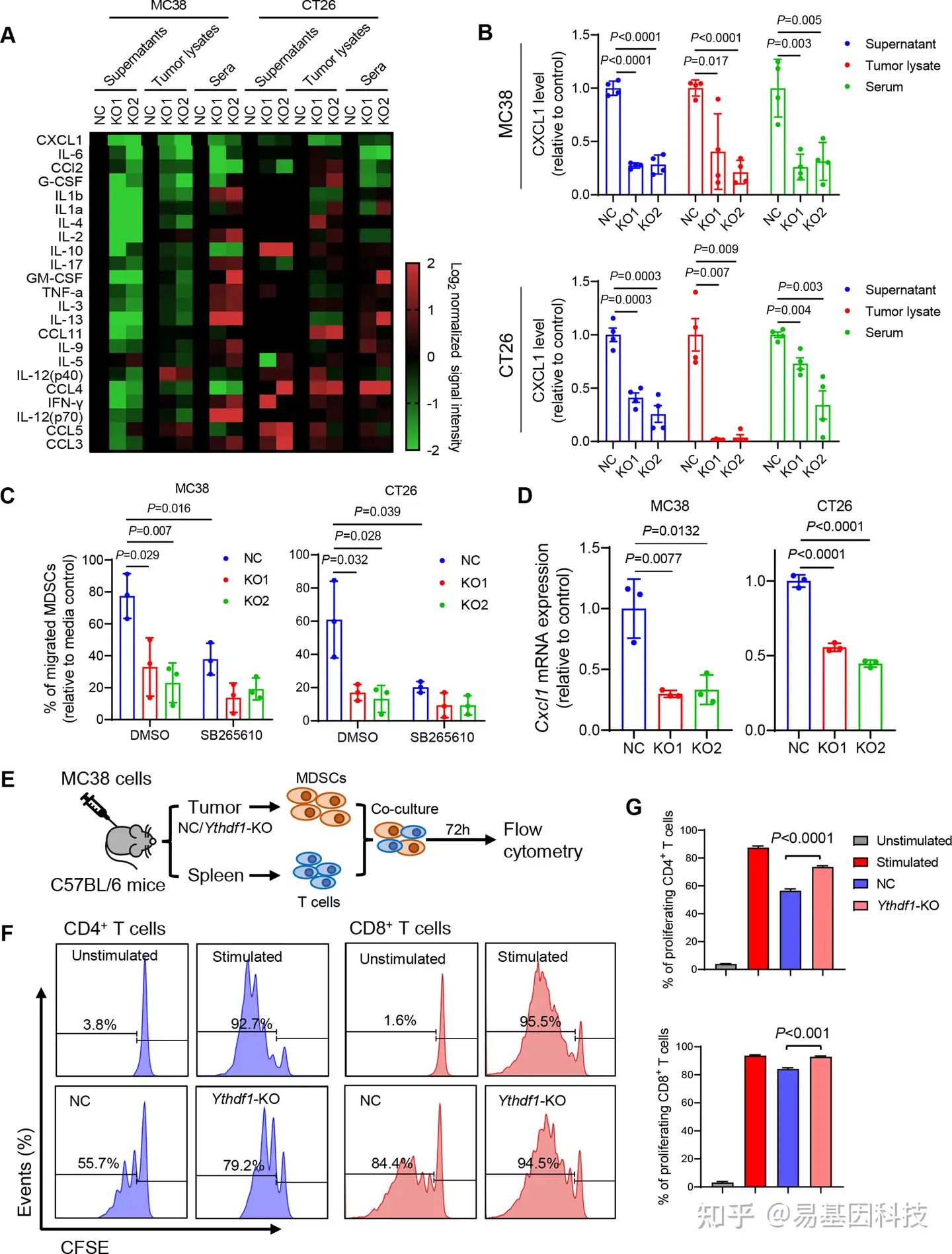
图6:YTHDF1敲除通过减少CXCL1分泌以促进髓源性抑制细胞(MDSC)的减少
(7)YTHDF1是结直肠癌免疫治疗的潜在靶点
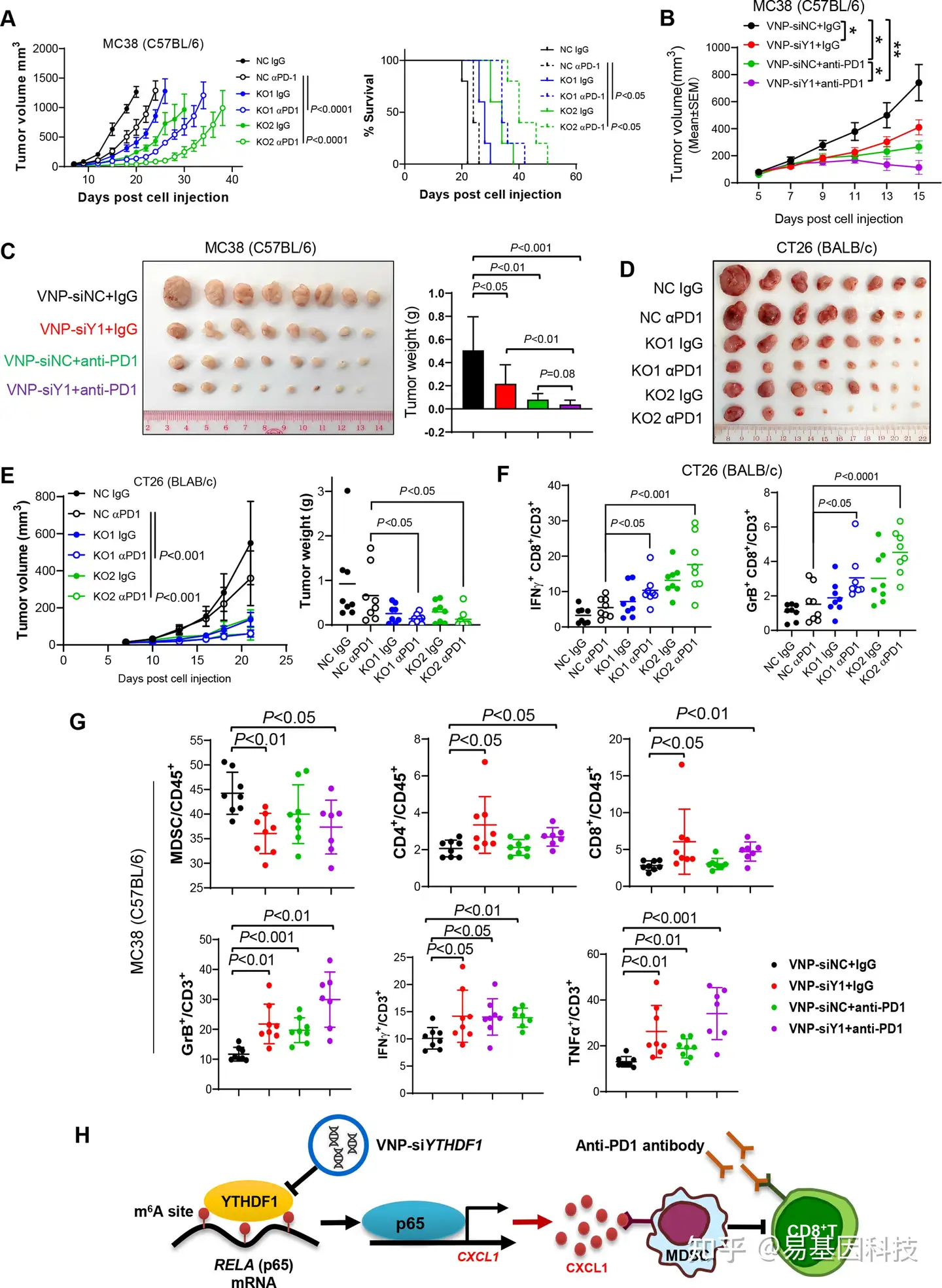
图7:靶向YTHDF1可以增强高微卫星不稳定(MSI-H)和微卫星稳定(MSS)结直肠癌(CRC)的抗PD1阻断治疗
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
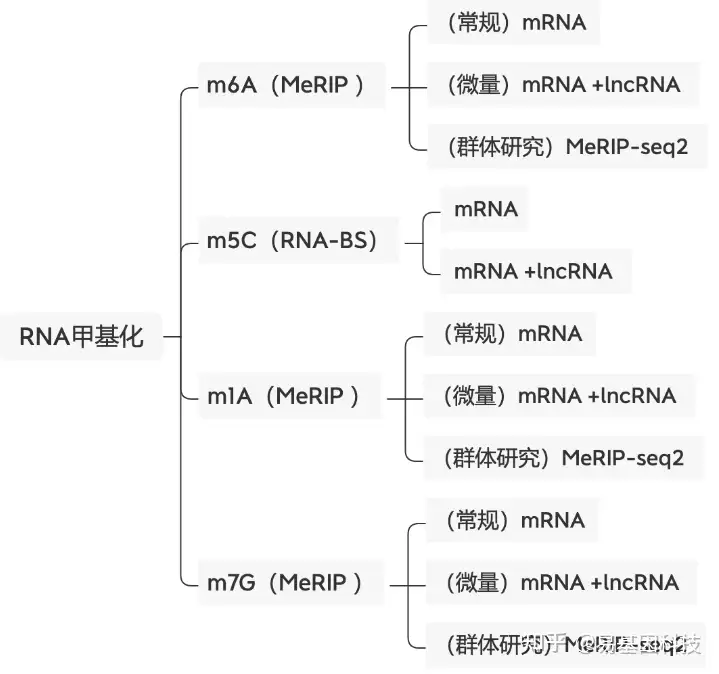
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
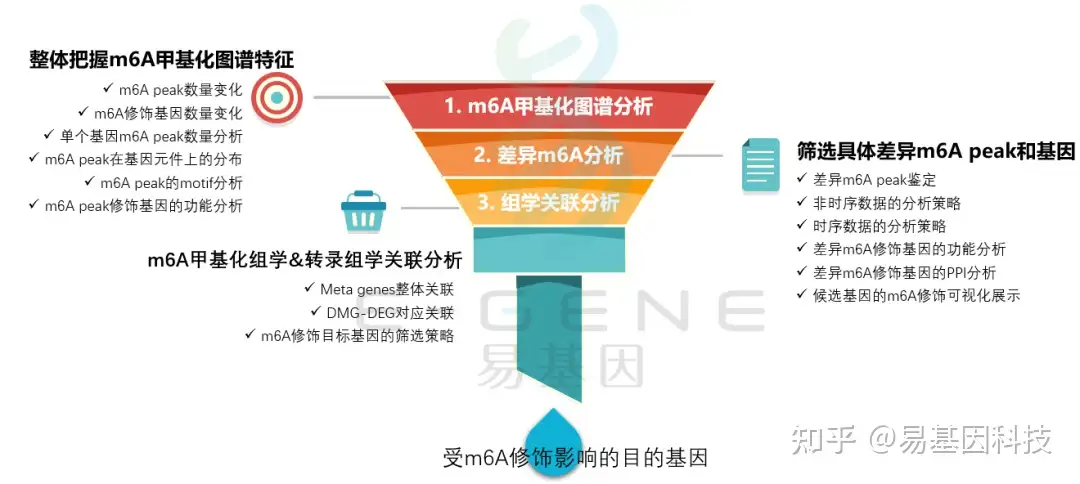
易基因科技提供全面的RNA甲基化研究整体解决方案。
参考文献:
Bao Y, Zhai J, Chen H, Wong CC, Liang C, Ding Y, Huang D, Gou H, Chen D, Pan Y, Kang W, To KF, Yu J. Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer. Gut. 2023 Jan 30.
相关阅读:
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究