
景杰生物 | 报道
肌节是心脏结构和收缩的基本单位,肌球蛋白头部在钙离子存在的情况下与三磷酸腺苷 (ATP) 结合,发生构象变化,并拉动细丝,从而导致心脏收缩。尽管已知肌球蛋白与肌联蛋白(Titin)存在动态的相互作用,但是它们如何相互结合和解离仍有待进一步研究。
乳酸以前被视为是新陈代谢的副产物,但它同时也是心脏的重要能量来源。越来越多的证据强调了乳酸在心脏肥大、损伤和心力衰竭中发挥的重要作用。但是,随着研究的进展,乳酸还可以通过介导蛋白质特定赖氨酸残基发生乳酸化修饰,影响组蛋白或非组蛋白的功能, 发挥其生物活性。乳酸作为心脏的重要能量来源,在心肌细胞中的生理和病理作用还知之甚少。
2023年7月13号,中国医科大学附属第一医院孙英贤教授团队在Cell Research(IF=44.1)发表了题为“”的研究论文。该文章利用乳酸化修饰组学技术,发现心力衰竭时心肌细胞存在乳酸浓度显著下降,进一步导致α-肌球蛋白重链(α-MHC)K1897乳酸化修饰水平降低以及α-MHC和肌联蛋白之间的相互作用显著降低,最终导致心力衰竭。中国医科大学附属第一医院心血管内科孙英贤教授为通讯作者;张乃今教授和张莹教授为第一作者,该研究获得国家自然科学基金资助。景杰生物为该研究提供了蛋白质组学以及乳酸化修饰组学技术支持。

-
心力衰竭患者以及小鼠的α-MHC K1897乳酸化修饰水平降低
研究者首先构建了小鼠心力衰竭模型,并收集了心力衰竭小鼠以及对照组小鼠的心脏组织,进行了蛋白质组学分析以及乳酸化修饰组学分析。研究者在对照组小鼠心脏组织中鉴定到2902个蛋白,159种乳酸化修饰蛋白以及576个乳酸化修饰位点。在心力衰竭小鼠心脏组织中共鉴定到3350种蛋白,160个乳酸化修饰蛋白以及 551个乳酸化修饰位点。在心力衰竭小鼠以及对照小鼠心脏组织中,共存在142种乳酸化修饰蛋白以及483个乳酸化修饰位点。
通过进一步数据分析,研究者发现心力衰竭小鼠心脏组织的α-MHC K1533、K1249和K1897位点的乳酸化水平均显著下降。但是与α-MHC K1533和α-MHC K1249相比,α-MHC K1897的乳酸化修饰下降幅度最大,α-MHC蛋白整体乳酸化修饰水平的减少主要源于K1897乳酸化的减少。此外,研究者还发现α-MHC K1897 残基和周围残基在包括人类、小鼠、大鼠、以色列鼹鼠、仓鼠、牛和非洲爪蟾等在内的许多物种中都是保守的。
为了验证乳酸化修饰组学结果,研究者通过Co-IP实验验证了心力衰竭小鼠的心肌组织α-MHC蛋白乳酸化修饰水平显著下降。研究者进一步生成了位点特异性抗体验证了在心力衰竭小鼠中 α-MHC K1897 位点乳酸化修饰水平存在显著下降。此外,研究者同时对人类心脏病理样本进行检测,发现心力衰竭标志物-B型利钠肽的浓度与α-MHC K1897乳酸化呈负相关关系。
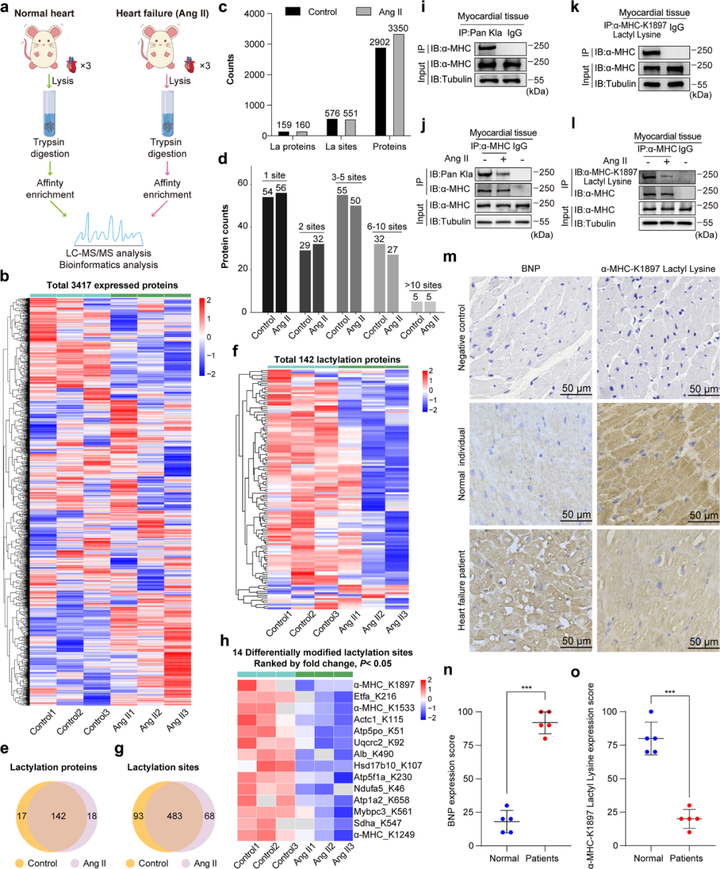
图1 心力衰竭小鼠和人类的 α-MHC K1897 乳酸化修饰水平降低
2. α-MHC K1897R突变减少α-MHC与Titin结合、加重心力衰竭
α-MHC和Titin之间的相互作用对于维持肌球蛋白的稳定性至关重要,而这种相互作用在心力衰竭期间显著降低。为了检测α-MHC K1897位点乳酸化是否影响其与Titin结合,研究者评估了生理条件下以及血管紧张素II(Ang II)处理条件下α-MHC K1897、K1533 和 K1249位点乳酸化修饰水平以及α-MHC和Titin之间相互作用的变化。结果表明,α-MHC K1897位点的乳酸化修饰会促进α-MHC-Titin相互作用。
研究者通过点突变的方式(将赖氨酸AAG密码子突变为精氨酸AGG密码子)进一步评估了α-MHC K1897乳酸化在心力衰竭中的作用,结果表明α-MHC K1897乳酸化水平的下调会直接导致心力衰竭,但对心肌肥厚没有明显的影响。
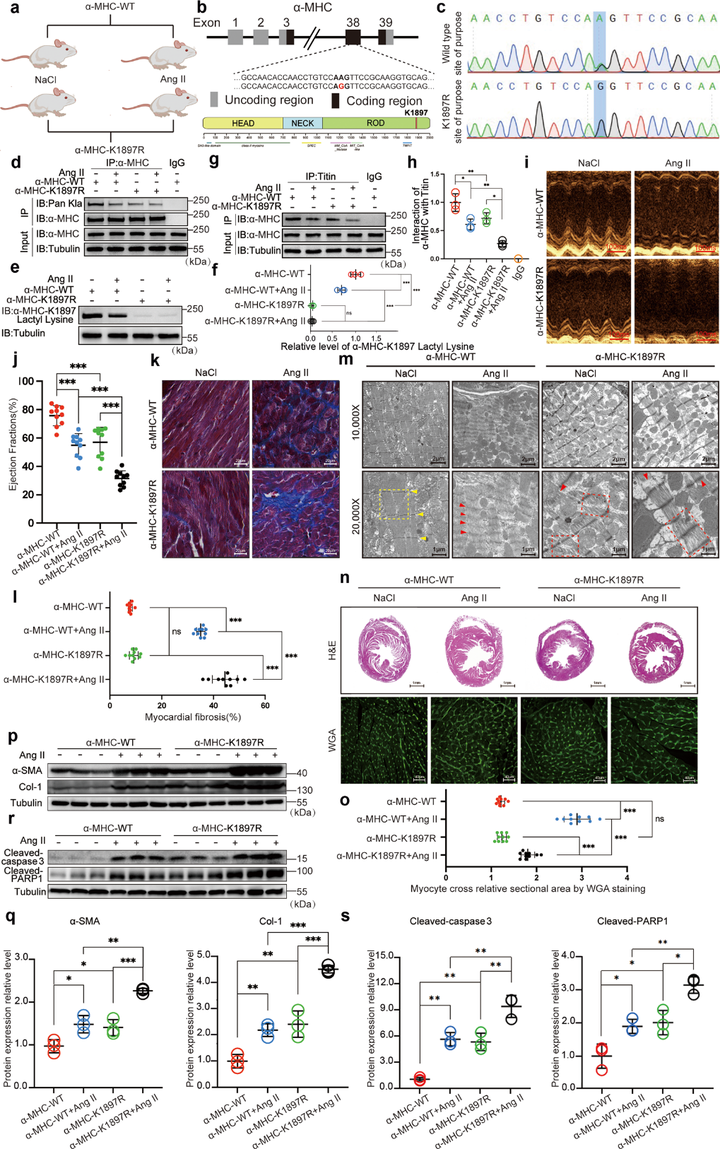
图2 α-MHC K1897R突变减少了α-MH与Titin的结合,加重心力衰竭
3. p300和SIRT1是α-MHC K1897乳酸化的酰基转移酶和乳酸化去修饰酶
鉴于α-MHC K1897的乳酸化在心力衰竭中发挥重要作用,研究者进一步探索了α-MHC乳酸化的酶促机制。研究者测试了多种酰基转移酶(p300、CBP、GCN5和PCAF等),发现p300过表达显著上调α-MHC乳酸化,并通过后续实验验证了p300是α-MHC K1897乳酸化的酰基转移酶。
除了鉴定α-MHC K1897乳酸化修饰的酰基转移酶,研究者进一步鉴定了相关的乳酸化去修饰酶。研究者测试了Sirtuin家族酶(SIRT1-7)作为α-MHC K1897乳酸化去修饰酶的活性,发现只有SIRT1的表达显著降低了α-MHC 乳酸化水平,也通过后续的系列实验证明了SIRT1是α-MHC K1897的乳酸化去修饰酶。
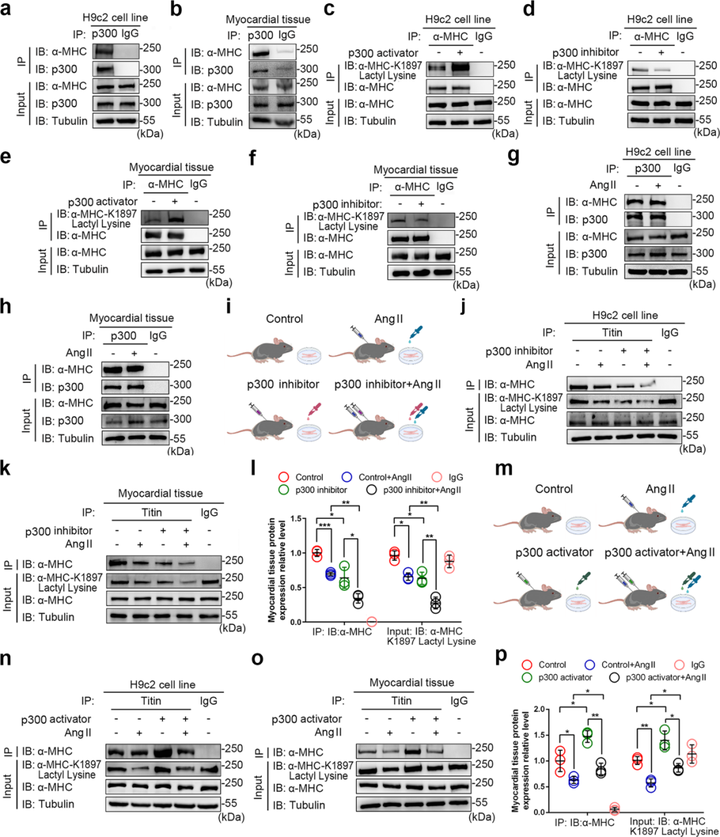
图3 p300 是用于 α-MHC K1897 乳酸化的酰基转移酶
4. 抑制乳酸脱氢酶-LDHA活性可降低乳酸浓度、抑制α-MHC K1897乳酸化并加重心力衰竭
LDHA是调节细胞中的乳酸含量的关键代谢酶之一,因此研究者推测LDHA可能作为调节因子影响α-MHC K1897乳酸化修饰水平。通过系列实验,研究者发现LDHA抑制剂显著减少了小鼠心肌组织中的乳酸水平以及α-MHC K1897乳酸化修饰水平。在LDHA-cKO小鼠中,LDHA的缺失也显著降低了心肌组织中的乳酸浓度与α-MHC K1897乳酸化修饰水平,进而减少α-MHC-Titin相互作用,加剧Ang II诱导的心力衰竭。
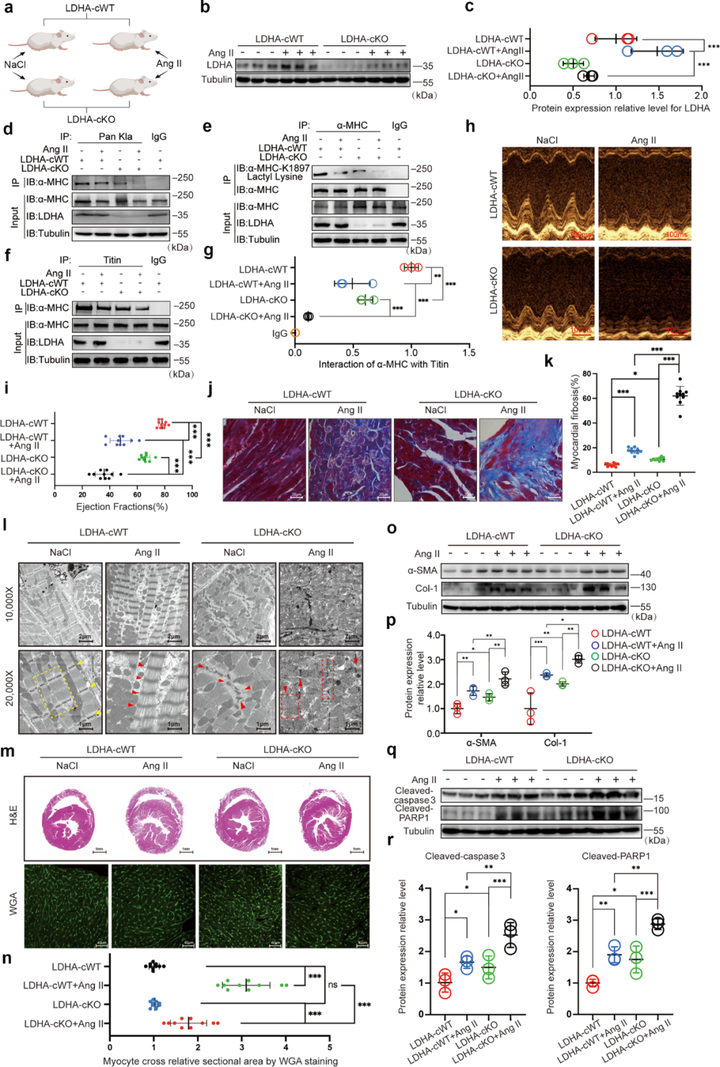
图4 LDHA-cKO小鼠降低α-MHC K1897乳酸化并加重心力衰竭
5. 乳酸钠(NALA)增加α-MHC K1897乳酸化、预防心力衰竭
研究者发现,NALA的施用可以显著增加体外细胞以及体内心脏组织以及血清中的乳酸浓度,并上调H9c2细胞和小鼠心肌组织中的α-MHC K1897乳酸化修饰水平,α-MHC-Titin相互作用也显著增加。研究者进一步检测了NALA在基线条件下对小鼠心脏生理功能的影响,发现NALA添加增加了小鼠的心脏左心室射血分数和缩短分数,显示出显著的心肌纤维化保护作用。但是,α-MHC K1897R会部分消除了NALA对Ang II诱导的心力衰竭的保护作用。上述结果表明,NALA可以通过在体外和体内增强α-MHC K1897乳酸化水平消除心力衰竭。
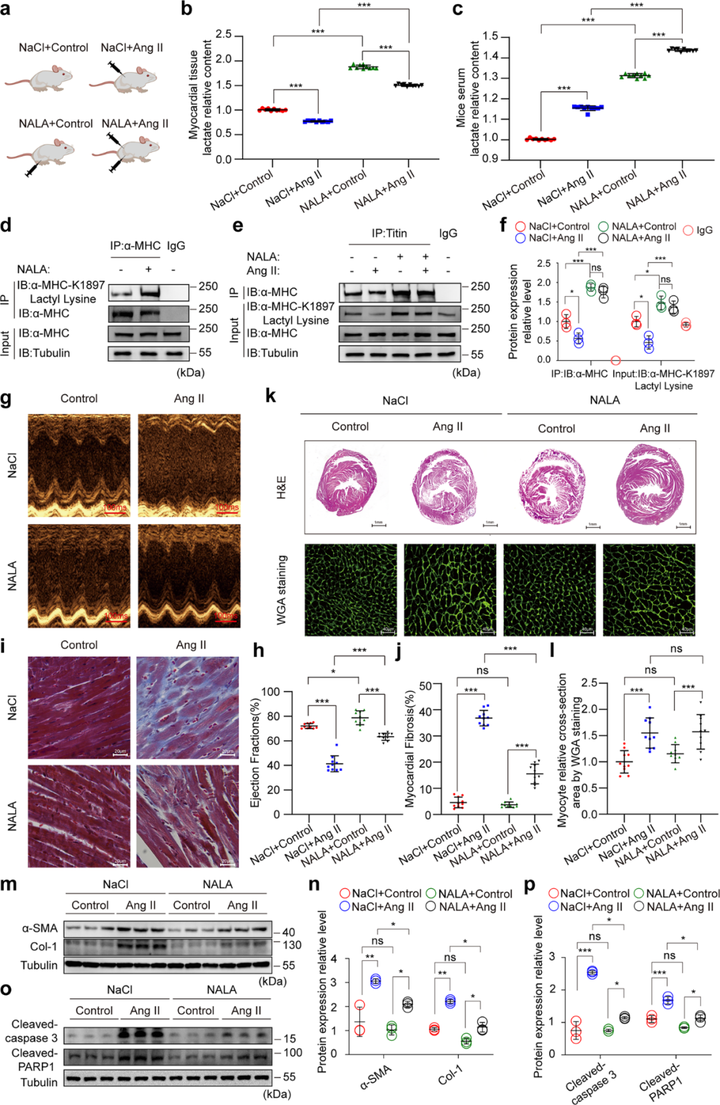
图5 NALA增加α-MHC K1897的乳酸化并预防心力衰竭
6. MCT4抑制剂-VB124增加α-MHC K1897乳酸化、预防心力衰竭
研究者进一步探索了心肌细胞中关键的乳酸转运蛋白-MCT4对于心衰的影响。研究者对α-MHC WT和α-MHC K1897R点突变小鼠进行了对照治疗或Ang II输注,然后对其施用MCT4抑制剂VB124。结果表明,在Ang II输注所导致心力衰竭小鼠模型中,VB124治疗会显著增加小鼠心脏组织α-MHC K1897乳酸化以及α-MHC-Titin相互作用,增加了左心室射血分数以及缩短分数。然而,α-MHC K1897R部分消除了MCT4抑制剂对Ang II诱导的体内心力衰竭的保护作用。总的来说,研究者的结果揭示了 α-MHC K1897乳酸化在心力衰竭中的关键作用。
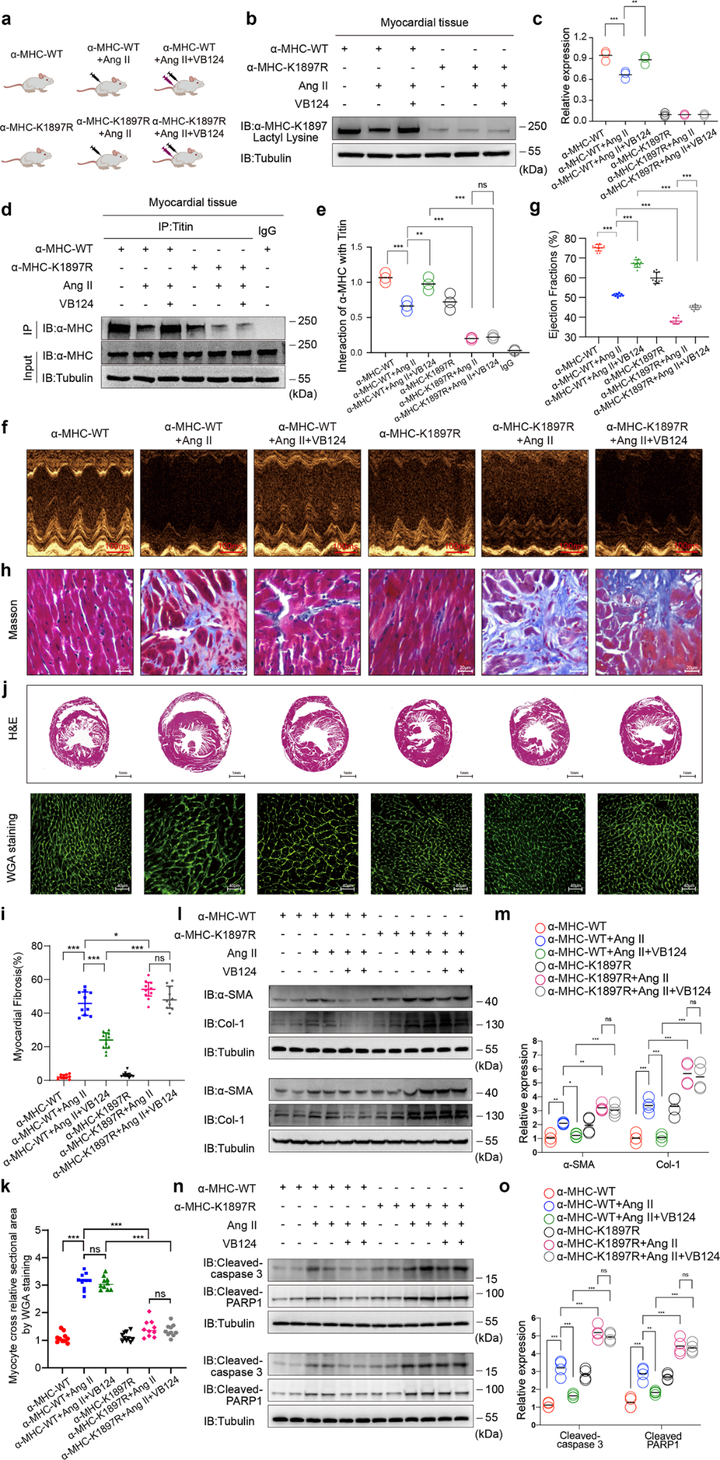
图6 MCT4抑制剂VB124增加α-MHC K1897乳酸化并预防心力衰竭,α-MHC K1897R突变部分消除VB124对Ang II诱导的心力衰竭的保护作用
综上所述,该研究通过乳酸化修饰组学检测揭示了心力衰竭小鼠心脏组织乳酸化修饰景观。研究者发现心衰心脏组织中乳酸水平存在显著降低,进一步导致α-MHC K1897乳酸化修饰水平和α-MHC和Titin之间的相互作用显著降低,容易导致心力衰竭。此外,
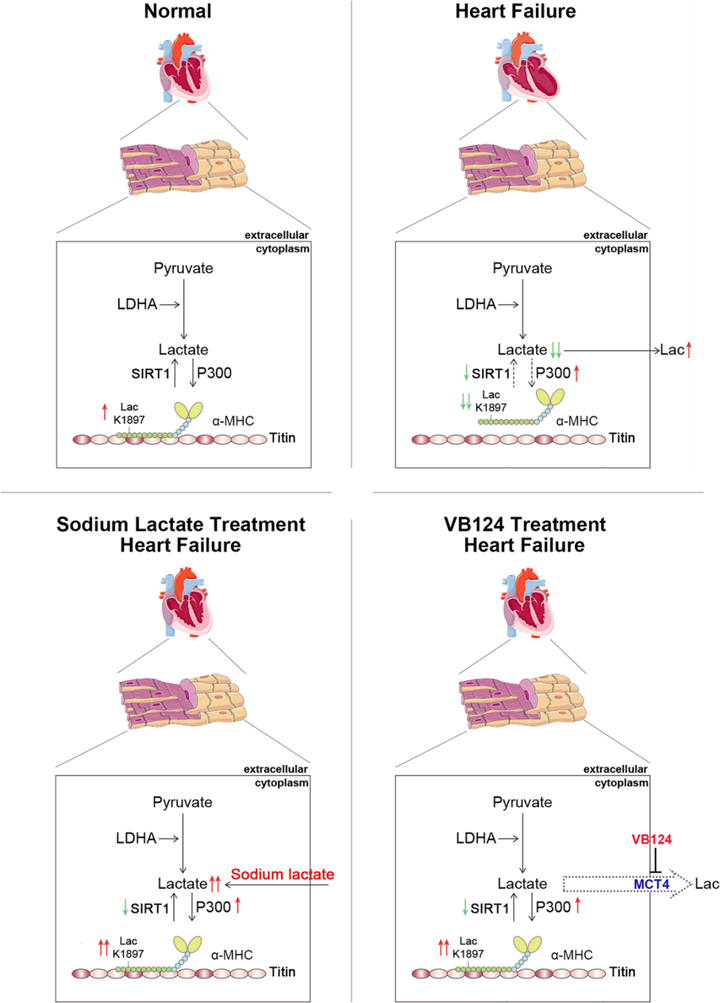
图7 α-MHC乳酸化机制研究示意图
参考文献: Naijin Zhang, . α-myosin heavy chain lactylation maintains sarcomeric structure and function and alleviates the development of heart failure.
景杰生物作为修饰组学领域的领跑者,拥有多种修饰抗体和修饰组学质谱检测服务。如果您想了解相关产品和服务的更多信息,请扫描下方二维码填写合作咨询表单、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询。