Thermodynamics---PV Diagram
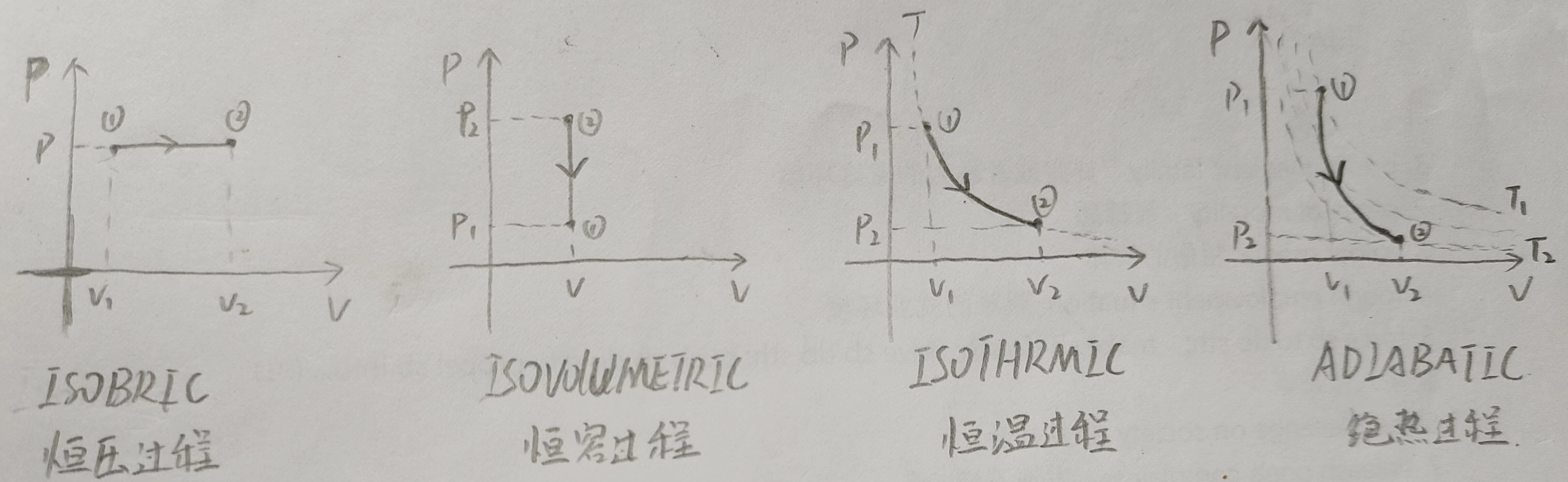
我们这里主要讨论上面四种PV图的\(\Delta U,Q,W\), 其中\(\Delta U\)是系统的内能,\(Q\)是系统吸收的能量,\(W\)是外界对系统做的功,我们在理想单原子气体上面讨论。
Preliminaries
我们一般把内能\(U\)看做温度和体积的函数,即\(U= U(V,T)\), 所以\(U\)的关于\(V,T\)的变化可以写为关于这二者的全微分
\(dU = (\frac{\partial U}{\partial T})_VdT+(\frac{\partial U}{\partial V})_TdV\)
又因为热一告诉我们
气体变化的内能等于气体吸收的热量与外界对其做功的和,即
\(\Delta U = \Delta Q+\Delta W\)
对于一个可逆过程,有\(\Delta W = Fdx = -\frac{F}{A}Adx = -pdV\)(负号的意思是dv为负,体积减小,外界做正功), 这样有
\(\frac{dQ}{dT} = \frac{dU+dW}{dT}= (\frac{\partial U}{\partial T})_V+((\frac{\partial U}{\partial V})_T+p)\frac{dV}{dT}\)
对于恒容过程来说\(dV = 0\), 且因为第一项是在容器体积一定的情况下讨论的,所以有
$(\frac{dQ}{dT})_V= C_V = (\frac{\partial U}{\partial T})_V $
即为恒容热容. 同样地,对于恒压过程来说,
\((\frac{dQ}{dT})_P = C_P = (\frac{\partial U}{\partial T})_V+((\frac{\partial U}{\partial V})_T+p)(\frac{\partial V}{\partial T})_p\)
即为恒压热容。
现在考虑1摩尔理想的单原子气体,理想的单原子气体的内能\(U\)全部是粒子的动能,根据能量均分定理,我们有
\(U = \frac{3}{2}RT = \frac{3}{2}Nk_BT\)
所以有
\(C_V = (\frac{\partial U}{\partial T})_V = \frac{3}{2}Nk_B\)
所以有\(U = C_VT\)
这里\(U\)与\(V\)无关,即对于理想气体
\((\frac{\partial U}{\partial V})_T = 0\)
因为是理想气体,所以根据\(PV= Nk_BT\), 有
\(\frac{\partial V}{\partial T} = \frac{Nk_B}{P}\)
\(C_P = C_V+Nk_B = \frac{5}{2}Nk_B\)
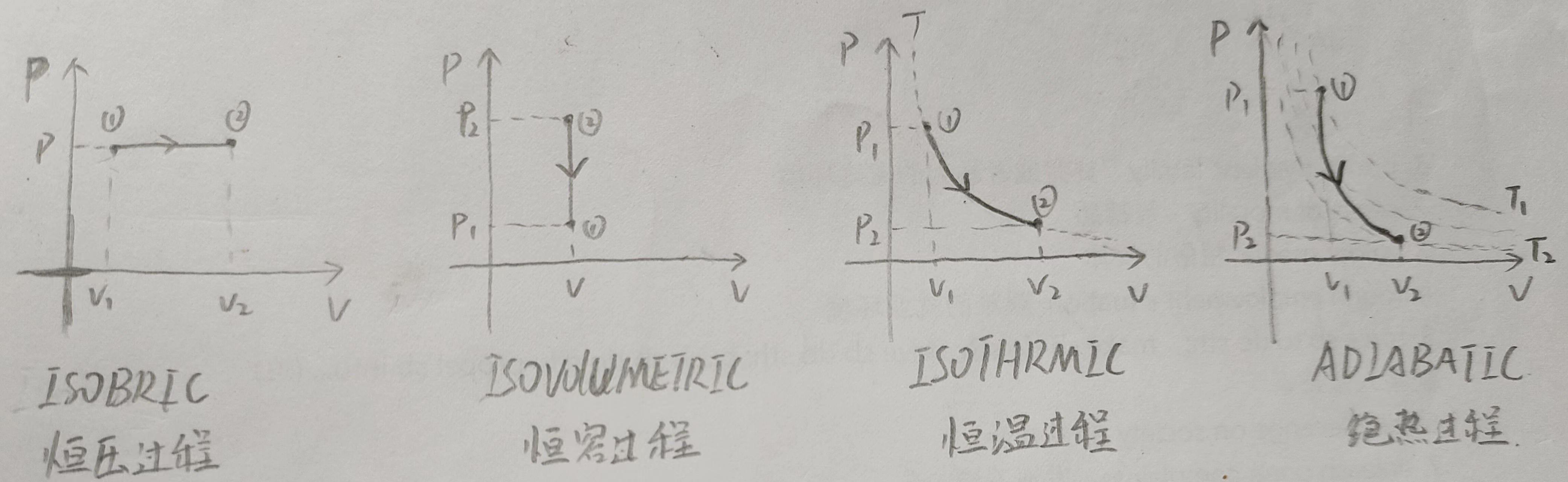
对于恒压过程
\(\Delta W = -PdV\)
这里\(dV\)是大于0的,所以气体对外做正功,导致气体的内能减小,即对于数值来说
\(\Delta U = \Delta Q -W\)
这里\(\Delta U = \frac{3}{2}Nk_B\Delta T\), 所以数值上
\(\Delta Q = \Delta U + W\)
恒压过程中,根据\(PV = Nk_BT\), 体积增大,温度升高,所以\(\Delta U\)是大于0的,这意味着\(\Delta Q\)也是大于0的,所以这个过程中,气体会从外界吸收热量。
对于恒容过程
\(\Delta W = 0\)
因为这里没有体积的变化,气体只有通过改变体积来对外做功,所以没有体积的变化就没有做功。所以\(\Delta U = \Delta Q =\frac{3}{2}V(P_2-P_1) = \frac{3}{2}Nk_B\Delta T=C_V\Delta T\)(第一个等号无论是在数值还是在符号上都成立)。
上述恒容过程中,同样地,体积不变,压强减小,温度降低,\(\Delta U\)是小于0的,所以\(\Delta Q\)是小于0的,所以这个过程中,气体会向外界放出热量。
对于恒温过程
因为是在恒温条件下,所以\(\Delta T = 0\), 所以有:\(\Delta U =0\)
所以数值上有\(\Delta Q = \Delta W\)
而数值上
\(\Delta W = \int_{v_1}^{v_2} \frac{Nk_BT}{V}dV = Nk_BT\ln(\frac{v_2}{v_1}) = P_1V_1\ln(\frac{v_2}{v_1}) = P_2V_2\ln(\frac{v_2}{v_1})\)
上述恒温过程中,体积增大,气体对外做正功,外界对气体做负功,所以\(\Delta W\)是小于0的,这意味着气体能量在减小,温度会降低,但这是个恒温过程,所以此时必须吸收热量来补偿,所以\(\Delta Q\)是大于0的。所以这个过程中,气体会从外界吸收热量。
对于绝热过程
因为绝热了,所以有\(\Delta Q = 0\)
所以数值上有\(\Delta U = \Delta W = C_V\Delta T\)
上述绝热过程中,气体膨胀对外做正功,所以外界对气体做负功,这意味着\(\Delta W\)是小于0的,此时没有外界的热量补充,温度会降低,所以\(\Delta U\)也是小于0的,也就是说绝热过程中,气体的内能是在减少的。