大家好这里是专注表观组学十余年,领跑多组学科研服务的易基因。
被称为表观转录组(epitranscriptome)的RNA修饰正成为基因调控的广泛调控机制。由于绘制转录组范围RNA修饰测序策略的改进,以及分别对沉积、去除和识别RNA修饰的writers、erasers和readers密集表征,表观转录组学领域最近取得了较大进展。本文综述了近年来植物表观转录组及其在转录后基因调控和不同生理过程中调控机制的研究进展,主要重点介绍了N6-甲基腺苷(m6A)和5-甲基胞嘧啶(m5C)。
在植物表观转录组中,m6A是mRNA上最普遍和最经典的内部修饰,其他包括m5C、m1A和ψ图谱,也已经在一些植物的转录组范围内进行了分析,并鉴定出其writers。此外,植物mRNA在其5′端也被修饰,如经典的m7G或非经典的NAD caps(图1a)。
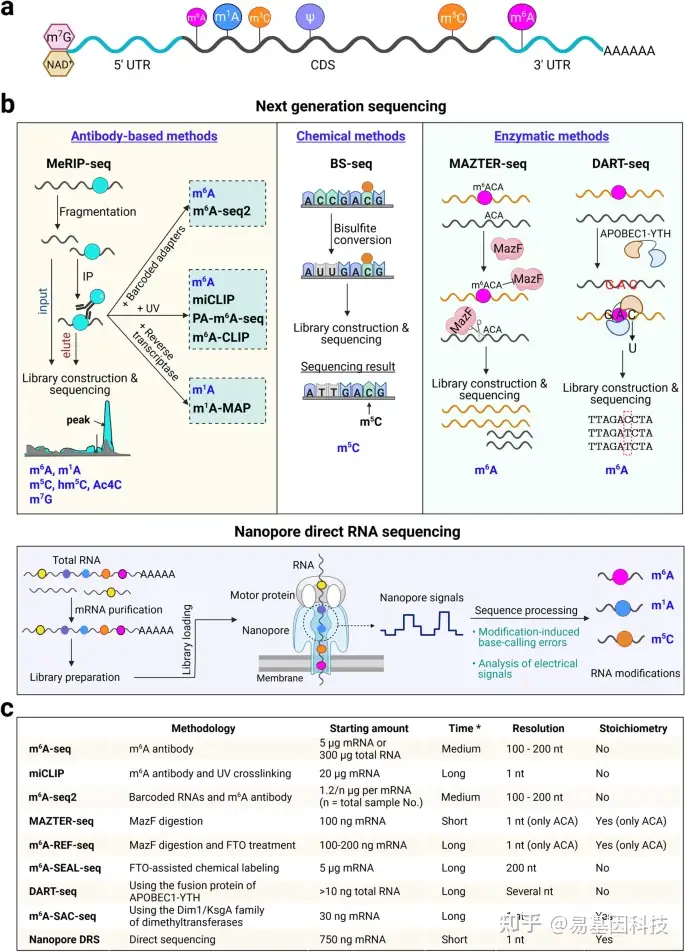
图1:植物表观转录组概述和表观转录组分析技术。
- 植物中已知的RNA修饰。转录本中不同RNA修饰的主要位点。在植物中,mRNA被N7甲基鸟苷(m7G)或烟酰胺腺嘌呤二磷酸(NAD)封端并含有内部修饰,包括N6-甲基腺苷(m6A)、N1甲基腺苷(m1A)、5-甲基胞嘧啶(m5C)和假尿苷(ψ)。
- RNA修饰图谱分析方法。将下一代测序与基于抗体、化学和酶的方法相结合的技术(上),Nanopore直接RNA测序(下)。
- 不同m6A分析技术的关键特征比较。星号表示文库构建和测序前样品制备所需时间。
表观转录组分析技术的进展
(1)基于抗体、化学和酶的表观转录组分析
将下一代测序与修饰RNA的抗体免疫沉淀相结合,包括m6A-seq、m1A-seq、m5C-seq、hm5C-seq、Ac4C-seq和m7G-seq(图1b),是迄今为止最常用的绘制各种RNA修饰图谱的方法。m6A-seq揭示了真核生物中数千个具有独特且保守分布的转录本中m6A甲基化的普遍性,这些转录本优先分布在终止密码子周围和3′非翻译区(UTR)。然而,这些方法在表观转录组标记位点信息上的分辨率欠佳(100–200nt)。可以引入额外步骤来改进用于以单碱基分辨率检测RNA修饰的方法。首先,将UV交联步骤结合到RNA免疫沉淀中,如m6A单核苷酸分辨率交联和免疫沉淀(miCLIP)、m6A交联免疫沉淀(m6A-CLIP)和光交联辅助m6A测序(PA-m6A-seq),但如果不利用甲基化加标对照或input文库进行矫正或标准化,这些方法无法量化样品之间的差异修饰。其次,应用特异性逆转录酶来提高RNA修饰的检测分辨率,这些修饰在逆转录过程中会诱导错误掺入,这些方法包括使用逆转录酶TGIRT的m1A图谱,用于m1A甲基化的高分辨率分析。此外,已经开发出使用与不同样本的RNA连接的条形码适配器的m6A-seq2,用于同时检测不同样本的m6A动态,该方法可以扩展到使用其特异性抗体来检测其他RNA修饰。
尽管基于抗体的方法具有多功能性,但其应用必须依赖于高质量的抗体和大量的起始RNA。基于化学诱导标记的亚硫酸盐测序(BS-seq)以检测m5C RNA修饰(图1b)已被开发用于表观转录组标记检测。亚硫酸盐处理将未甲基化的胞嘧啶(C)转化为尿嘧啶(U),从而产生一种可以以单核苷酸分辨率下绘制m5C的标记。在植物中,BS-seq已用于检测tRNA、rRNA和mRNA中的m5C。
酶技术的最新发展为以抗体非依赖性方式定量绘制m6A的精确位点提供了另一种有用的替代方案。这些技术要么利用m6A敏感的RNA限制性内切酶,如MAZTER-seq和m6A-REF-seq,要么利用m6A-erasers/readers,如m6A-SEAL和DART-seq,或利用二甲基转移酶如MjDim1将m6A转化为m62A的m6A选择性烯丙基化学标记和测序(m6A-SAC-seq)。
(2)Nanopore直接RNA测序检测表观转录组标记位点
尽管上述基于下一代测序方法的表观转录组分析方法为RNA修饰分布和调控提供了前所未有的见解,但在多个样品中定量绘制RNA修饰图谱仍然存在挑战。此外这些方法在很大程度上依赖于基于短读长cDNA的测序,其需要将RNA转化为cDNA。相比之下,Nanopore(纳米孔)长读长直接RNA测序(DRS)平台正在成为一种有前途的方法,用于定量绘制和比较不同条件下单核苷酸分辨率的RNA修饰(图1b)。在植物中,通过nanopore DRS为两个m6A-writers缺失的拟南芥突变体生成了高分辨率的差异和比较m6A甲基化组。此外,nanopore DRS和Tombo已被用于鉴定拟南芥中的m5C peaks,其总体模式与m5C-seq鉴定相似。
此外还开发了RAM-NPPS、BERMP和PEA等方法来检测植物中的m6A水平。其中PEA检测拟南芥中m6A的敏感性和特异性超过70%。所有检测方法都有其优点和缺点,如不同的m6A分析技术需要从100 ng到20μg的不同RNA起始量,具有不同的检测分辨率和推断化学计量信息的能力(图1c)。在设计表观转录组分析研究时,应将这些特征与要解决的生物学问题结合起来考虑。
表征植物表观转录组参与者的研究进展
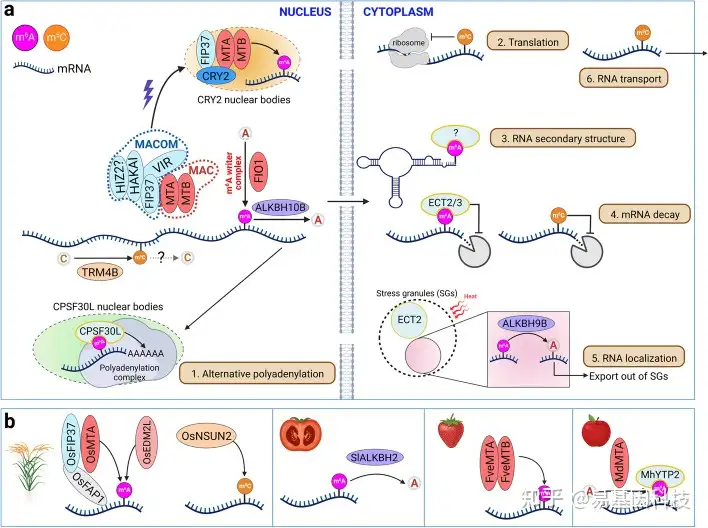
图2:m6A和m5C的效应基因和分子功能概述。
- 拟南芥中m6A和m5C的效应基因和分子功能。m6A主要通过细胞核中的多组分m6A甲基转移酶复合体沉积到其靶转录本上。该复合体可分为两个子复合体,即m6A METTL复合体(MAC)和m6A METTL相关复合体(MACOM)。在蓝光处理后,MTA、MTB和FIP37被招募到CRY2核体中,用于中心振荡器转录本的m6A甲基化。另一种m6A甲基转移酶FIO1单独起作用,将m6A沉积在转录本的子集中。m6A被细胞核中的ALKBH10B或细胞质中的应激颗粒(SG)中的ALkbH1B去除。m6A被细胞核中的CPSF30L或细胞质中的ECT2/3识别。m5C由TRM4B催化。RNA修饰在许多方面影响RNA代谢,包括(1)选择性多腺苷酸化,(2)翻译,(3)RNA二级结构,(4)RNA稳定,(5)RNA定位,和(6)RNA转运。
- 作物中m6A和m5C的一些已知效应基因。

表1:拟南芥中m6A和m5C效应基因的功能域,亚细胞定位和功能
在“功能域”列中,蓝色表示低复杂度区域。PLACC,病毒样氨基酸组成(Prion-like Amino Acid Composition);CC,卷曲螺旋域(coiled-coil domain);ZnF,锌指结构域(zinc finger domain);RRM;RNA识别motif(RNA recognition motif)。
植物m6A动态变化与调控研究进展
(1)不同植物的m6A特征
在包括梨、苹果、草莓、大豆、甘蓝型油菜、拟南芥、番茄、水稻、玉米等在内多种植物中,已经用m6A-seq或Nanopore DRS在转录组范围内对m6A靶标和分布进行广泛的分析。m6A甲基化比率从普通小麦中的29%到13种植物中的51%不等。在从绿藻到高等陆生植物的大多数植物中,m6A在终止密码子和3′UTR周围中的分布偏好高度保守(图3a),表明m6A是一种进化上保守的RNA修饰。尽管其丰度较低,但在梨、草莓、沙棘、甘蓝型油菜和水稻等几种植物中均检测到CDS区域中的m6A标记。在极少数情况下,m6A在苹果叶中的CDS区域富集最高。这些结果表明,CDS中的m6A可能是具有功能意义的重要特征。例如,在草莓果实成熟过程中,CDS中的m6A peaks值增加,意味着CDS中的m6A可能与不断变化的发育环境有关。此外,在拟南芥、梨和沙棘的起始密码子周围,以及苹果、甘蓝型油菜和甜高粱的5’UTR内也可以检测到m6A富集。
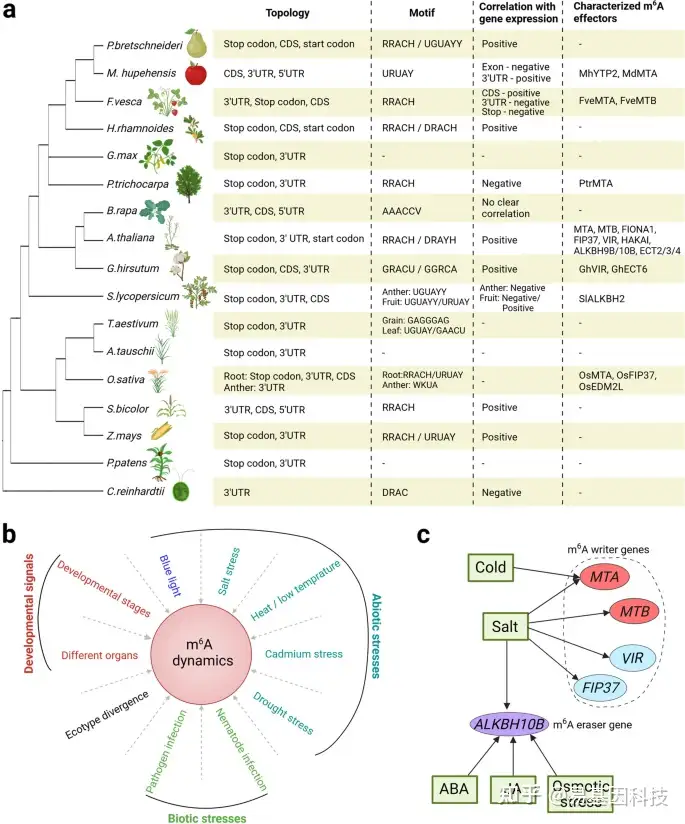
图3:植物中m6A RNA甲基化特征。
- 植物中m6A甲基化的关键特征概述。具有已知m6A谱的植物的系统发育树中(左)。根据Pyrus bretschneideri(梨)、Malus hupehensis(苹果)、Fragaria vesca(草莓)、Hippophae rhamnoides(沙棘)、Glycine max(大豆)、Populus trichocarpa(毛果杨)、Brassica rapa(甘蓝型油菜)、Arabidopsis thaliana(拟南芥)、Gossypium hirsutum(棉花)、Solanum lycopersicum(番茄)、Triticum aestivum(普通小麦)、Aegilops tauschii(粗穗硬草)、Oryza sativa(水稻)、Sorghum bicolor(高粱)、Zea mays(玉米)、Physcomitrella patens(苔藓)和Chlamydomonas reinhardtii(绿藻)的研究总结了关键的m6A特征(右)。在这些特征中,“与基因表达的相关性”在转录组范围内显示。R=A/G;W=A/U;K=G/U;Y=C/U;D=A/G/U;H=A/C/U;V=A/G/C。
- m6A修饰受各种内源性和环境信号的影响,如以下研究所示:发育阶段(草莓、小麦);不同植物器官(拟南芥);生态型分化(拟南芥);蓝光效应(拟南芥);高盐胁迫(拟南芥、甜高粱、水稻、甜菜、棉花);高温/低温胁迫(甘蓝型油菜、拟南芥、番茄);镉胁迫(水稻、大麦);干旱胁迫(沙棘、杨树、苹果);病原体感染(苹果、水稻、小麦、西瓜、梨);线虫感染(大豆)。
c、 在拟南芥中,m6A writers和m6A erasers基因的表达多种外部刺激的调节。箭头表示正调节。
在不同植物中,m6A主要分为两个序列motif,包括保守的RRACH motif和植物特异性的URUAY(Y=C/U)motif,独特的AAACCV(V=A/G/C)motif仅在甘蓝型油菜(pak choi)中有报道(图3a)。另外,m6A可能出现在同一植物的不同发育阶段的不同序列环境中。例如在普通小麦中,GAGGGAG和UGUAY motif分别出现在谷物和叶片的m6A peaks中。
(2)m6A分布的动态调节
m6A甲基化在不同的发育阶段动态变化,并对不同植物的环境刺激做出响应(图3b)。在包括根、莲座叶和花在内的不同拟南芥组织中,显示差异m6A修饰的转录本比例显著大于显示不同转录水平的转录本,表明m6A可能有助于器官分化。
m6A修饰也受到各种环境胁迫的动态影响。非生物胁迫(如盐胁迫、干旱胁迫和高温胁迫)或生物胁迫(如病毒和真菌疾病),不会显著影响3'UTR和终止密码子周围的整体m6A分布模式,但会极大地诱导选定转录本上的动态m6A重新分布。盐胁迫显著增加拟南芥幼苗和水稻枝条中的m6A甲基化水平,但不增加水稻根中的m6A甲基化水平;盐胁迫诱导m6A动态沉积到盐胁迫相关的转录本中,以保护它们在拟南芥中不被降解,并且还增加一些耐盐相关转录本的m6A甲基化,以增强它们在甜高粱中的RNA稳定性。干旱胁迫会导致干旱响应基因的m6A水平发生变化,从而影响它们在苹果中的表达水平。镉(Cd)胁迫在大麦根中诱导转录组范围的m6A高甲基化并改变水稻中大量转录本的甲基化水平。总之,这些观察结果表明应激诱导的m6A重新分布在应激响应中的重要作用。
尽管许多研究已经揭示了植物m6A甲基化的动态变化在植物不同组织器官、不同年龄和不同应激依赖性方式中的重要作用,但迄今为止其潜在机制仍然难以捉摸。这种动态的m6A调节在各种情况下可以部分地通过滴定(titration)m6A writers和erasers水平来实现,从而导致整体的m6A水平重新分布。在拟南芥中,盐胁迫可以通过上调m6A writer基因MTA、MTB、VIR和FIP37的表达而增加m6A甲基化(图3c)。ALKBH10B表达也在盐胁迫中上调,表明盐胁迫诱导的m6A动态变化由m6A writers和erasers水平增加共同作用。干旱胁迫降低了沙棘中的m6A甲基化,这与m6A去甲基化酶基因HrALKBH10B/10C/10D的表达显著增加有关。除转录调控外,在各种条件下m6A效应基因的转录后修饰或m6A recruiters招募也可能促进m6A动态变化。例如在蓝光处理后,MTA、MTB和FIP37被招募到CRY2核体中,用于中心振荡器转录本上的选择性m6A甲基化。进一步探索在各种条件下选择性转录本上m6A动态变化的潜在机制将有助于对m6A依赖性动态调控的机制理解。
植物表观转录组在基因调控中的研究进展
RNA修饰通过影响mRNA代谢的各个方面来决定植物mRNA命运,包括可变剪接(alternative splicing,AS)、可变聚腺苷酸化(alterative polyadenylation,APA)、折叠(folding)、翻译、定位、转运和衰变(图2a和图4)。这些对mRNA代谢的影响最终影响植物发育和应激响应中的一系列生理过程,正如对RNA修饰效应基因中缺陷的突变体集合所表征的。
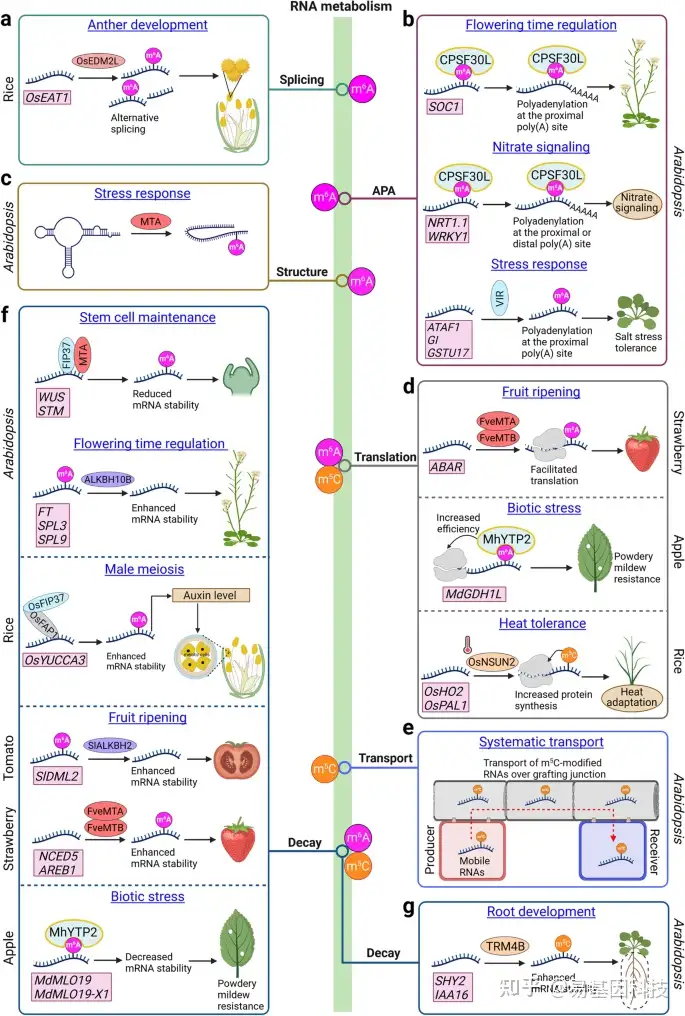
图4:表观转录组介导的RNA代谢及其对植物发育、细胞过程和应激响应的影响。
- OsEDM2L介导OsEAT1的m6A修饰,导致水稻花药发育中OsEAT1的可变剪接。
- m6A修饰影响拟南芥中的可变聚腺苷酸化(alternative polyadenylation,APA)。CPSF30L与m6A修饰的SOC1 mRNA结合调节其APA并生成相对稳定的SOC1转录本,从而导致较短的3'UTR以促进开花。CPSF30L还通过调节硝酸盐信号通路中几种m6A修饰的转录本(包括NRT1.1和WRKY1)的APA来介导硝酸盐信号。VIR介导盐胁迫响应中几种应激相关转录本的m6A修饰和APA。
- mRNA腺苷甲基化酶(MTA,METTL3的直系同源物)在盐胁迫应答转录本上的m6A沉积与RNA二级结构减少相关,导致RNA稳定性增加。
- m6A修饰影响几种作物中的蛋白质翻译。在草莓果实成熟中,FveMTA和FveMTB介导的ABAR m6A修饰促进其翻译。在苹果中,MhYTP2与m6A修饰的MdGDH1L结合促进其翻译以赋予白粉病抗性。在水稻中,OsNSUN2依赖性m5C修饰增加蛋白质合成以增强水稻对热应激的响应。
- 在拟南芥中,m5C RNA修饰通过嫁接连接调控RNA转运。
- m6A修饰影响各种植物中的RNA稳定性。在拟南芥中,FIP37和MTA介导的WUS和STM的m6A修饰降低了它们的mRNA稳定性以维持正常的干细胞活性。m6A erasers ALKBH10B使FT、SPL3和SPL9去甲基化,从而增强其mRNA稳定性以促进拟南芥开花。在水稻中,OsFIP37与OsFAP1相互作用以在OsYUCCA3转录本上沉积m6A修饰以促进雄性减数分裂所需的生长素生物合成。在番茄果实中,SlALKBH2去甲基化并增强SlDML2稳定性以加速果实成熟。在草莓中,FveMTA和FveMTB在NCED5和AREB1转录本上沉积m6A修饰,从而增强其RNA稳定性以促进果实成熟。在苹果中,MhYTP2与MdMLO19和MdMLO19-X1的m6A修饰的转录本的结合,使其转录本不稳定以促进对白粉病的抗性。
- TRM4B依赖性m5C修饰增强了其靶转录本在拟南芥根发育中的RNA稳定性。
展望
在过去的十年中,植物表观转录组在不同植物胁迫下的m6A动态以及对模式植物拟南芥和水稻中m6A和m5C修饰的机理理解方面取得了快速进展。目前的证据有力表明,表观转录组学标记是转录后基因调控的重要层面,其决定mRNA命运并最终影响植物发育和对各种环境胁迫的响应。然而,我们对植物表观转录组的理解仍处于起步阶段。关于表观转录组标记靶标选择性和功能模式的许多未解决问题仍有待探索。例如,writers和erasers如何在不同的生理环境中选择他们其标靶?mRNA修饰如何响应环境刺激而动态调节?reader蛋白如何识别其靶标并在随后的RNA代谢过程中发挥作用?此外,由于RNA修饰高度依赖于细胞环境,在不同的组织和器官、不同的发育阶段或不同的应激下,相关的调节通路可能不同。因此,有必要通过新开发的分析技术以单核苷酸分辨率分析从组织水平到细胞水平的RNA修饰动态变化,这将推进和扩展我们在植物表观转录组知识的理解。
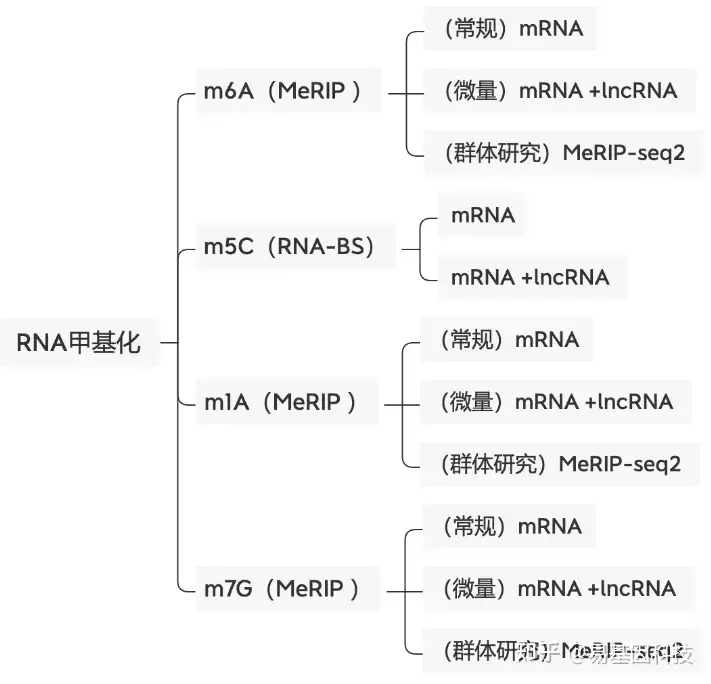
易基因科技提供全面的表观转录组学测序研究解决方案服务,包括m6A甲基化修饰、m1A修饰、m5C甲基化、m7G修饰。
参考文献:
Shen L, Ma J, Li P, Wu Y, Yu H. Recent advances in the plant epitranscriptome. Genome Biol. 2023 Mar 7;24(1):43. pii: 10.1186/s13059-023-02872-6.
相关阅读:
技术推介|RNA m⁶A甲基化测序(MeRIP-seq)技术介绍
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究