大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
m7G修饰是RNA转录后修饰之一,存在于许多不同类型的RNA中。通过对RNA中m7G修饰的准确鉴定,揭示了m7G在基因表达调控和不同生理功能中的作用。越来越多的证据表明,m7G修饰在癌症发生中至关重要。本文综述了m7G的检测技术、分布、生物学功能和调控因子的最新研究进展,还总结了m7G修饰与癌症发展、耐药性和肿瘤微环境之间的关系,并讨论了未来的研究方向和趋势。
Introduction
表观遗传学是指在不改变基因核苷酸序列的情况下基因表达的可遗传变化,包括DNA甲基化、组蛋白修饰和RNA修饰。近年来,RNA修饰成为新的研究热点,已鉴定出170多种RNA修饰,包括N6甲基腺苷(m6A)、N7甲基鸟苷(m7G)、5-甲基胞嘧啶(m5C)、N1甲基腺苷(m1A)、N3甲基胞胞嘧啶(m3C)和假尿苷(ψ)(图1),在RNA代谢和转录后调控等生物学过程中发挥重要作用。随着测序技术的快速发展,m7G已成为RNA修饰的新研究热点。
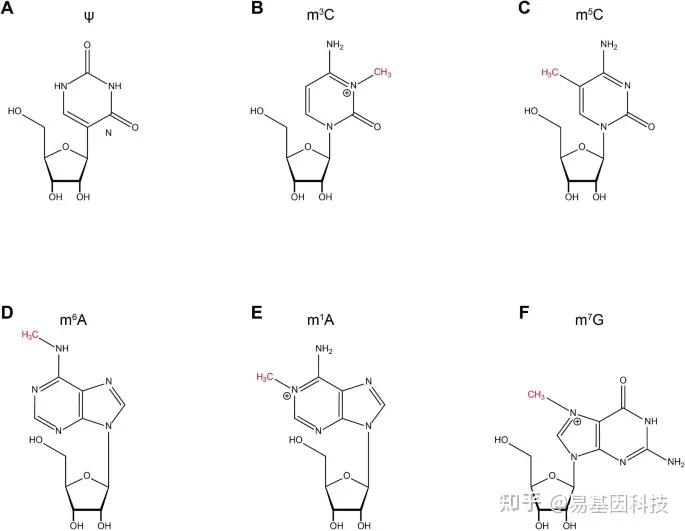
图1:常见RNA修饰的分子式
(A)Ψ (B)m3C (C)m5C (D)m6A (E)m1A (F)m7G
在真核生物、原核生物和古细菌中经常观察到带正电荷的m7G修饰。m7G修饰通常存在于mRNA、tRNA、rRNA、miRNA和真核生物mRNA的5′cap端,几乎影响RNA代谢的整个过程,包括pre-mRNA剪接、mRNA结构稳定、转录、翻译和出核。2019年,Zhang等人首次证实哺乳动物mRNA中存在m7G,并率先发明了一种新型表观遗传学测序方法(m7G-seq),揭示m7G修饰的分布位点,为m7G后续修饰的相关研究奠定了基础。
m7G不仅参与RNA的正常生理代谢,而且最近研究还表明,m7G和相关调节因子在肿瘤中似乎相当失调。因此本文综述了m7G修饰的生物学作用、肿瘤发生的潜在分子机制以及进一步研究的前景。
m7G修饰的检测方法
RNA修饰检测是研究m7G修饰基因表达调控的基础。主要方法包括定量检测和高通量测序(表1)。前者以液相色谱-质谱(LC-MS/MS)和Northern blot为代表,用于分析tRNA中m7G整体修饰程度。此外,rRNA m7G修饰水平可以通过引物延伸检测。然而上述技术的分辨率有限,无法在单核苷酸碱基分辨率下检测m7G修饰位点。
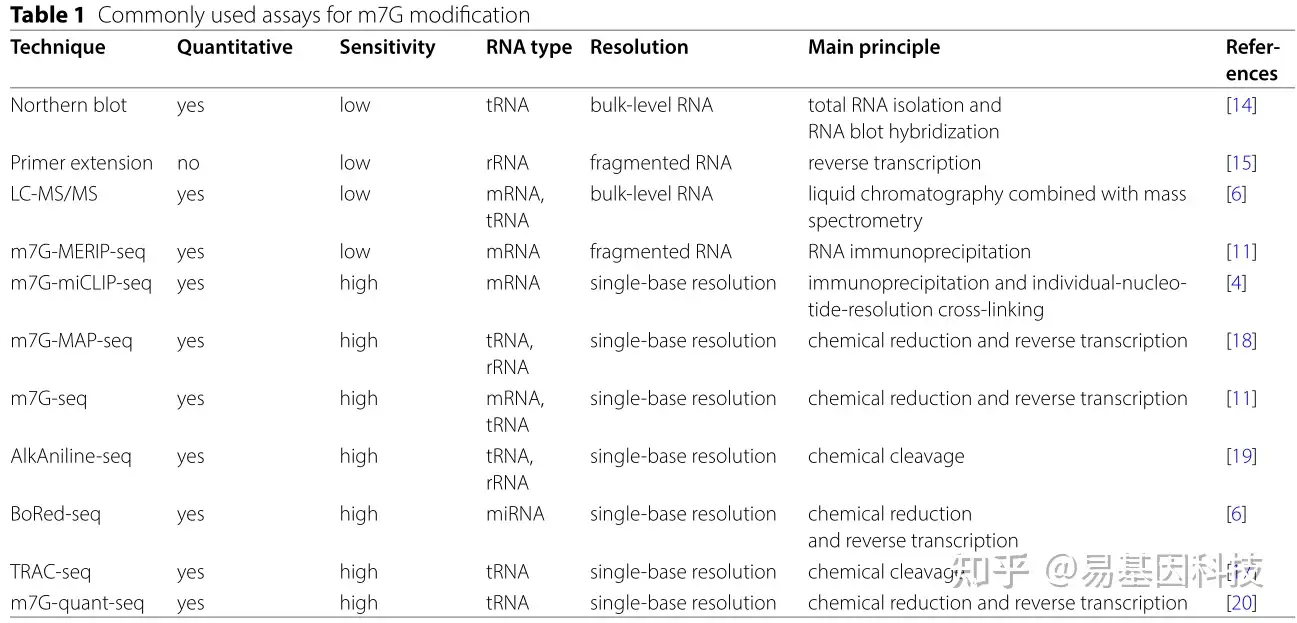
表1:m7G修饰常用检测方法
高通量测序是指使用抗体免疫沉淀或化学方法准确定位RNA中m7G修饰位点。基于抗体的分析主要包括甲基化RNA免疫沉淀与下一代测序结合(m7G MERIP-Seq)和免疫沉淀测序(m7G-miCLIPseq)。由于抗体的非特异性结合,两种测序方法都容易出现假阳性。前者只能检测哪些mRNAs发生m7G甲基化修饰,而后者可以以单碱基分辨率鉴定特定m7G修饰位点。基于化学检测的分析主要有两种类型,一种是化学还原法和逆转录方法,如m7G MAP-seq、m7G-seq。m7G-seq利用化学还原和脱氨作用选择性将m7G位点转化为碱性位点,并通过逆转录酶成功检测mRNA中的m7G信号。m7G MAP-seq通过硼氢化盐将m7G位点还原为碱性位点,通过逆转录直接记录为cDNA突变并测序。另一种是化学裂解介导的检测,如碱性水解和苯胺裂解测序(AlkAniline-Seq)和tRNA还原和切割测序(TRAC-Seq)。AlkAniline-Seq通过苯胺裂解产生5'-磷酸键,用于文库制备。TRAC-Seq在原理上相似,只是前者使用总RNA作为起始材料,而后者使用小RNA作为起始材料,并加入AlkB去甲基化和硼氢化盐还原步骤,从而实现tRNA高效逆转录。上述四种化学方法都以单核苷酸分辨率检测m7G修饰位点,但由于m7G位点的部分还原、脱氨和裂解,其准确性仍然较差。为此,Zhang等人进一步优化m7G-Seq,开发了m7G-quant-Seq,实现tRNA内m7G位点的高效还原和纯化。
RNA中的m7G修饰
近年来随着测序方法的不断改进,鉴定RNA甲基化的整体修饰水平和内部位点已成为可能。m7G修饰已被证明存在于mRNA、tRNA和rRNA中(图2),并在人体的正常生理功能中发挥重要作用(图3)。
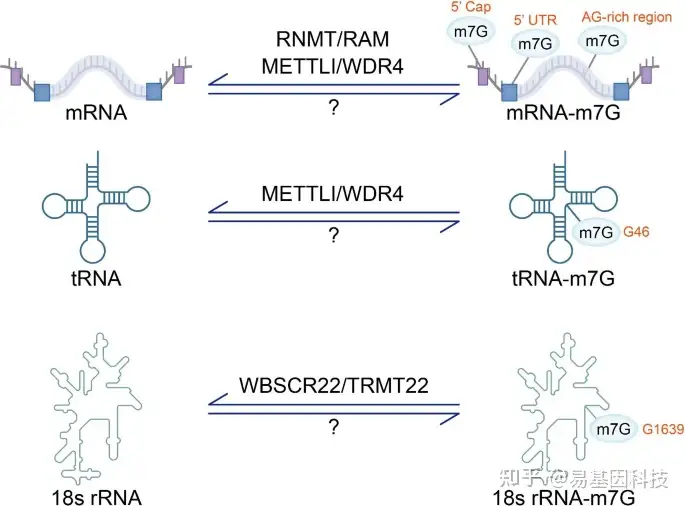
图2:m7G在RNA中修饰的过程和位点。
m7G修饰存在于mRNA的5’cap、5’UTR和A-G富集区域。其中5’cap甲基化由RNMT/RAM介导,mRNA甲基化由METTL1/WDR4介导。METTL1/WDR4在tRNA G46位点催化m7G甲基化酶。甲基转移酶WBSCR22/TRMT112催化18s rRNA G1639位点
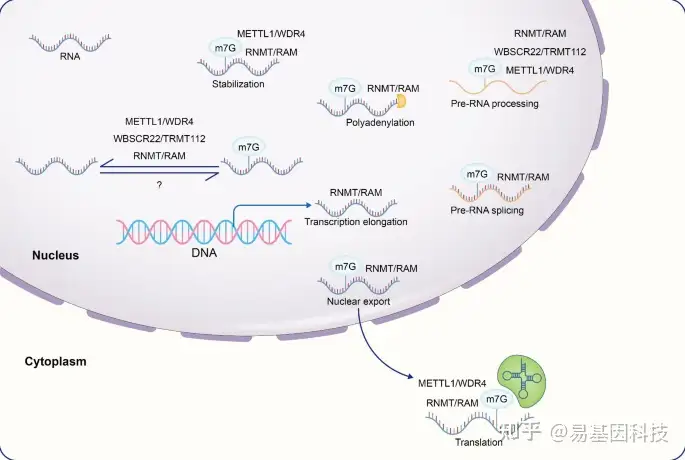
图3:RNA代谢参与m7G修饰过程。
m7G调控因子参与RNA的转录后延伸、剪接、多腺苷酸化、出核和翻译,还稳定转录后RNA结构
mRNA中的m7G修饰
真核生物mRNA m7G最早发现于其5'端。RNMT/RAM甲基转移酶复合体以SAM为甲基供体,在鸟嘌呤核苷酸的N7位点形成m7G(5')ppp(5'”)X的“cap”结构。m7G cap与真核生物翻译起始因子(elF4E)结合并参与翻译起始。它可以与cap结合复合物互作,招募Npl3和Yra1,并增加mRNA出核;可以抵抗相关RNA水解酶活性,并稳定mRNA结构。
此外,mRNA中也有许多m7G修饰位点。Zhang等人发现,敲除m7G cap后,哺乳动物mRNA中的m7G占比0.02%-0.05%。基于MERIP-seq和逆转录方法,利用m7G易发生化学还原反应的特性,开发了一种新的测序方法——m7G-seq,实现了m7G修饰在mRNA内碱基分辨率的精确定位。使用这项技术,他们发现m7G在mRNA 5'UTR、编码序列(CDSs)和3'UTR以及AG富集区域中显著富集。Malbec等人通过m7G-miCLIP-seq在人和小鼠细胞中mRNA 5’端AG富集的非编码区发现了m7G peaks;同时还发现尽管m7G修饰在哺乳动物中高度保守,但在应激条件下mRNA中的m7G修饰动态调控。一旦发生热休克和氧化应激,mRNA CDSs和3'UTR区域中m7G修饰丰度显著增加,5'UTR中m7G修饰丰度明显降低,mRNA翻译效率提高。考虑到3'UTR是基因表达和翻译的关键调控区,有理由怀疑3'UTR中的m7G修饰位点是调节mRNA翻译效率的开关。
ncRNA中的m7G修饰
m7G修饰不仅在调控mRNAs翻译中起着重要作用,而且对ncRNAs表达和功能也具有重要意义。
目前,tRNA中的m7G修饰研究最多。可变环第46位的N7鸟嘌呤原子通常被tRNA甲基转移酶甲基化,生成m7G46。它与L型tRNA结构中C13-G22碱基对的氢键(hydrogen bond)互作,形成一种特殊带正电荷的M7G46-C13-G22结构,稳定tRNA的三维核心。m7G46于1965年首次在酵母tRNA中检测到,通过Trm8p/Trm82p异二聚体复合体形成m7G修饰。后来Zhang等人使用m7G-Seq证实了哺乳动物tRNA中m7G修饰的存在。与mRNA类似,ncRNA中的m7G修饰位点在AG序列中也显著富集。反密码子区域的tRNA修饰在翻译调控中至关重要,并通过提高癌基因的翻译效率来促进癌症发生和发展。同时,一旦tRNA中的m7G46修饰缺失,会导致神经发育相关疾病,表明m7G-tRNA参与神经谱系正常分化。
rRNA中也存在m7G修饰。在酵母18S rRNA上,位于P位点和E位点tRNA之间脊上的G1575被Bud23-Trm112甲基转移酶复合体N7甲基化,而人类18S RNA G1639位点具有类似结构。此外已经证明细菌16s RNA G1405位点被选择性甲基化以形成m7G修饰,导致对氨基糖苷类药物的耐药性。然而m7G修饰在rRNA中的作用尚不完全清楚,需要进一步研究。
m7G修饰也发生在miRNA中。Pandolfini等人通过开发硼氢化物还原测序(BoRed-seq)技术,成功在miRNAs let-7e-5p特定亚群的G11位点鉴定出m7G修饰。m7G促进miRNA中G-四链体产生,并有助于pre-miRNA加工。Enroth等人利用m7G-maP-seq在包括人Let-7e在内的miRNA中未检测到m7G修饰。因此,需要更多的高通量测序技术来进一步检测miRNA中的m7G修饰。
m7G的调控因子
m7G修饰及相关调控因子在维持人体正常生理功能和癌症发生中起着重要作用。到目前为止,哺乳动物中的m7G调控因子包括METTL1/WDR4、RNMT/RAM和WBSCR22/TRMT112等甲基转移酶,可以将活性甲基从供体转移到鸟gan第N7位的RNA核糖体,形成m7G修饰。
METTL1/WDR4
METTL1是最典型的RNA m7G甲基转移酶,通常与WDR4形成复合体来催化甲基化反应。METTL1位于12q13区,含有276个氨基酸,可折叠成8个α-helice和7个β-sheet。METTL1在体内和体外被PKB和RSK在Ser27位点磷酸化,失去活性并促进细胞生长。WDR4是WD重复蛋白家族成员,位于21q22.3区,含有412个氨基酸,可折叠成4个α-helice和28个β-sheet,是酵母Trm8p/Trm82p同源物。研究表明,WDR4表达与METTL1蛋白水平显著相关,表明WDR4是METTL1的重要辅因子。METTL1/WDR4复合体通常能够在tRNA可变环的G46位点引入m7G修饰,稳定并影响tRNA的三级结构和功能,并受胰岛素和相关生长因子调控。METTL1/WDR4复合体参与胚胎干细胞的自我更新和分化,在小鼠胚胎干细胞(mESC)中,METTL1基因被敲低。一方面会影响细胞分裂和集落形成率,另一方面干扰胚胎干细胞向神经谱系分化,并促进内胚层和中胚层谱系分化。而WDR4突变会导致独特的小头原发性侏儒症,伴有明显的面部和大脑畸形和癫痫发作,可能由tRNA中m7G甲基化修饰减少诱导。最近研究还表明,较低的METTL1/WDR4与唐氏综合征、多发性硬化症、脑缺血和阿尔茨海默病等神经系统疾病之间存在强相关性。具体机制有待今后进一步阐明。
同时,METTL1/WDR4复合体能够通过tRNA m7G修饰变化来介导mRNA翻译有效性。研究表明METTL1沉默会损害m7G tRNA修饰,导致tRNA结合位点(位点A)的核糖体悬浮液增加,并阻断核糖体易位,从而降低蛋白质丰度,降低细胞内mRNA的整体翻译效率。相反,由于METTL1上调而导致mRNA翻译效率增加与癌症发展密不可分。研究表明,METTL1上调导致m7G tRNA(尤其是Arg-TCT tRNA)的甲基化修饰水平增加,从而减少了AGA密码子区域的核糖体停顿,并促进与细胞周期和致癌mRNA调控相关的mRNA翻译效率,导致癌症发生和进展。
此外,METTL1还可以促进缺血后血管生成。研究表明,METTL1能够以m7G修饰依赖性方式增加VEGFA mRNA翻译,并促进血管内皮细胞的增殖和迁移。这可能成为缺血性脑部疾病的新治疗靶点。
WBSCR22/TRMT112
WBSCR22/TRMT112作为酵母Bud23-Trm112的功能同源物,已被证明是一种m7G甲基转移酶复合体,参与18S rRNA的m7G甲基化修饰。WBSCR22最初被鉴定为威廉姆斯综合征(Williams syndrome)中发现的26个基因之一,包含核定位信号和高度保守的S-腺苷-L-甲硫氨酸结合基序(motif)。WBSCR22参与器官再生和伤口愈合过程,增强糖皮质激素受体功能,调节肺部炎症,并与癌症发生和耐药性相关。微小进化保守蛋白TRMT112通过WBSCR22辅因子参与rRNA m7G修饰,TRMT122对WBSCR22代谢稳定至关重要,两者组装成异二聚甲基转移酶复合体,促进pre-rRNA加工合成18S rRNA,并在18S rRNA G1639位点发生m7G修饰。
Pre-rRNA加工不需要WBSCR22甲基转移酶的催化活性。在WBSCR22甲基转移酶的关键功能残基上取代氨基酸突变体对Pre-rRNA加工没有影响。但如果WBSCR22基因沉默,成熟18S rRNA数量将显著减少,表明甲基转移酶可以在Pre-rRNA加工后帮助成熟rRNA甲基化修饰,而不依赖于其催化作用。18S rRNA m7G1639的功能尚不清楚,但其高度保守性对核糖体的翻译过程有重要影响。
RNMT/RAM
人RNMT也是m7G修饰的调控因子,是一种由476个氨基酸组成的核蛋白。RNMT和T细胞之间可能存在互作。RNMT是TCR刺激诱导T细胞活化的关键介质。同时活化的T细胞也有助于RNMT通过m7G帽合成mRNA、rRNA和snoRNA,特异性调控核糖体丰度,提高翻译效率。RAM是由RNMT激活的亚基,两者相互结合形成稳定的复合体结构,有助于在mRNA修饰的5’cap端引入m7G,并促进mRNA成熟。此外RAM促进甲基供体招募,增强RNMT甲基转移酶活性,并调节m7G修饰以及mRNA帽上相关基因的表达。
癌症中m7G的异常表达
尽管目前对m7G修饰的研究还不够充分,但越来越多证据表明,m7G修饰参与癌症发生发展机制,并与耐药性相关。m7G修饰在各种最常见癌症中的作用(图4)和相关机制(图5)如下:
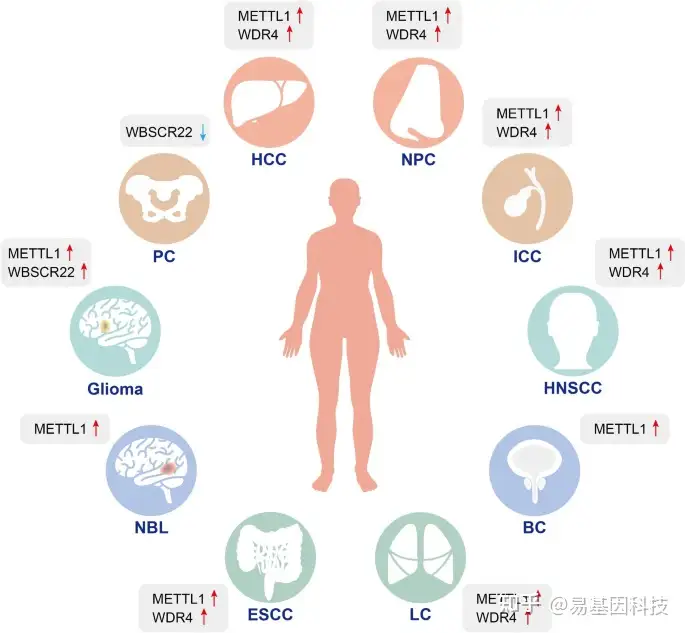
图4:m7G修饰在各种肿瘤中的异常表达。
m7G调控因子作为促进剂促进HCC、NPC、ICC、HNSCC、BC、LC、ESCC、NBL、胶质瘤(Glioma)的增殖和进展,并作为抑制剂抑制PC的发展。
HCC:肝细胞癌;NPC:鼻咽癌;ICC:肝内胆管癌;HNSCC:头颈部鳞状细胞癌;LC:肺癌;ESCC:食管鳞状细胞癌;NBL:神经母细胞瘤;BC:膀胱癌;PC:胰腺癌
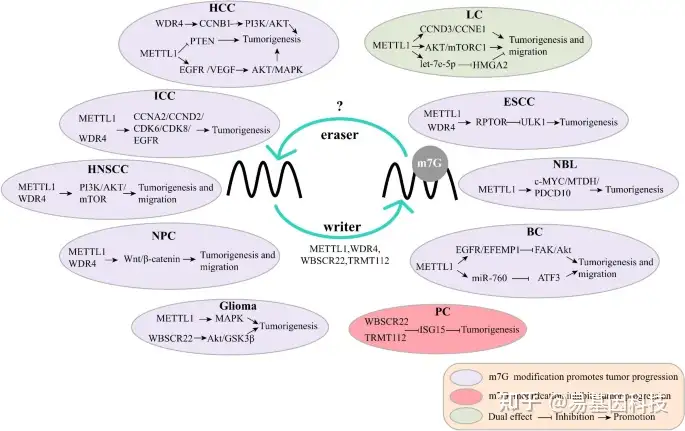
图5:m7G修饰在癌症发生发展中的调控机制
肝癌(Liver cancer)
肝癌是世界第五大常见癌症,是男性和女性癌症相关死亡的第二和第四大病因,预后极差。原发性肝癌主要包括肝细胞癌(HCC)和肝内胆管癌(ICC),前者来源于肝实质细胞,占肝细胞癌发病率的80%。后者来源于胆管上皮细胞,比HCC恶性程度更高,三年生存率仅为30%。
研究表明,m7G tRNA修饰及其甲基转移酶METTL1、WDR4和WBSCR22在HCC中显著升高,促进肝细胞癌细胞的增殖、迁移和侵袭。在HCC中,METTL1敲除会导致tRNA m7G修饰减少,mRNA翻译效率严重受损,细胞周期蛋白A2、EGFR和VEGFA蛋白表达水平降低。同时,EGFR和VEGFA的下游信号通路Akt和MAPK活性降低,使细胞周期停滞,抑制HCC进展。METTL1还可以通过下调PTEN通路活性来促进HCC进展,表明METTL1可以通过多种通路在肝细胞癌发展中发挥调控作用。同时WDR4促进G2/M细胞周期转变,导致细胞增殖。通过促进EIF2A与CCNB1mRNA结合,CCNB1翻译效率提高,激活PI3K/AKT信号通路,协助EMT转化。CCNB1可以泛素化p53并降解p53,从而促进癌变。WBSCR22调控肿瘤的主要机制正在研究中,毫无疑问METTL1、WDR4和WBSCR22是未来治疗肝细胞癌的潜在靶点。
此外,METTL1/WDR4复合体在ICC中也显著上调。METTL1敲除降低了mRNA的总翻译水平,因为它导致m7G tRNA依赖性解码密码子频率降低和核糖体停顿增加。METTL1敲除不会改变癌症相关基因mRNA水平,但其翻译效率受损,导致细胞周期相关蛋白如CCNA2、CCND2、CDK6、CDK8和EGFR下降,从而影响肿瘤进展。
头颈部鳞状细胞癌(HNSCC)
头颈部鳞状细胞癌(HNSCC)来源于口腔、咽部和喉部的粘膜上皮细胞,是世界第六大常见癌症。METTL1/WDR4复合体上调促进肿瘤发展和转移。机制上METTL1/WDR4复合体减少降低了tRNA m7G水平,并抑制参与PI3K/AKT/mTOR相关通路基因的mRNA翻译。由于PI3K/AKT/mTOR通路磷酸化水平降低,其下游相关蛋白包括Cyclin D1、波形蛋白(Vimentin)、MMP9、Bcl-2和P-S6K表达降低,抑癌基因bax表达增加。同时研究表明,METTL1介导的PI3K/AKT/mTOR通路磷酸化促进了HNSCC发展,靶向METTL1将成为未来重要的治疗靶点。
鼻咽癌(NPC)是一种HNSCC,但其流行病学和发病机制与HNSCC并不完全相同。NPC中METTL1/WDR4上调增加m7G tRNA表达,并通过上调WNT/β-catenin信号通路,增加EMT转化并促进癌变。
膀胱癌(BC)
膀胱癌(BC)是世界第九大常见恶性肿瘤,尿上皮癌是其主要病理类型。近年来人们发现METTL1增加与BC出现呈正相关。机制上METTL1通过促进tRNA m7G修饰来增加tRNA解码频率,从而提高EGFR/EFEMP1翻译效率,并抑制其下游信号通路FAK/Akt信号。另一项研究表明,METTL1通过miR-760轴影响BC进展。METTL1以m7G依赖方式促进pre-miR-760加工,并有助于miR-760成熟。miR-760增加将下调致癌蛋白AFT3,表明METTL1通过m7G-miR-760/ATF3轴调节BC进展。由于miRNA倾向于与其靶向mRNA 3'非编码区结合,从而沉默mRNA表达。METTL1可能成为BC治疗的重要潜在靶点。
肺癌
近年来,肺癌发病率逐渐上升,死亡率居世界首位。尽管肺癌靶向治疗取得了突破,但5年生存率仅不到20%。METTL1和WDR4在肺癌组织中表达上调,促进肿瘤细胞增殖和迁移。METTL1缺失会降低m7G tRNA表达,导致细胞周期调节因子CCND3和CCNE1 mRNA翻译效率降低。METTL1通过AKT/mTORC1信号通路抑制A549细胞增殖和自噬。Pandolfifini等人发现METTL1通过促进m7G miRNAs加工而减少肺癌迁移。METTL1通过AKT/mTORC1信号通路抑制A549细胞的增殖和自噬,这可能是由于miRNAs抑制靶基因翻译。METTL1对肺癌发生既正调控作用,也具有负调控作用。
食管癌
食管癌是世界第八大常见恶性肿瘤,主要分为食管鳞状细胞癌(ESCC)和食管腺癌,食管鳞癌是亚洲食管癌的主要亚型。METTL1和WDR4高表达与食管鳞癌预后不良呈正相关,METTL1敲除导致核糖体在m7G tRNA解码的密码子区域停顿,从而显著降低RPTOR(mTOR复合物1的调节相关蛋白)的翻译效率,提高其下游靶基因ULK1的磷酸化水平,导致ESCC细胞死亡和自噬增加,减缓ESCC的迁移和进展。METTL1/RPTOR/ULK1自噬轴是未来ESCC治疗的重要靶点。
神经母细胞瘤
神经母细胞瘤(Neuroblastoma,NBL)是一种来源于交感神经系统的神经内分泌肿瘤。虽发病率低,但却是儿童最常见的颅外实体癌。由于其生存率低,因此开发新的治疗策略至关重要。研究发现,METTL1在NBL中的过表达是导致预后不良的显著危险因素。通过促进m7G tRNA表达,METTL1提高了c-MYC转录激活基因组和细胞周期的mRNA翻译效率,包括常见癌基因metadherin(MTDH)和程序性细胞死亡10(PDCD10)。
神经胶质瘤(Glioma)
神经胶质瘤是一种来源于神经胶质细胞的原发性脑肿瘤,恶性程度极高,WTO分为低级别胶质瘤(LGG)和高级别胶质瘤(HGG)。METTL1和WBSCR22均在胶质瘤中高表达。METTL1的胶质瘤分级依赖性增加表明METTL1显著增强肿瘤细胞的生长。MELL1对下游MAPK信号通路的刺激可能是造成这种情况的原因。WBSCR22通过磷酸化Akt和GSK3,提高胶质瘤细胞中β-连环蛋白和CyclinD1水平以促进肿瘤细胞增殖。
胰腺癌(ancreatic cancer)
胰腺癌是一种恶性程度极高的消化道肿瘤。5年生存率为7%,发病率与死亡率相当。由于预后极差,了解其病理生理学至关重要。WBSCR22可抑制肿瘤细胞增殖和迁移,TRMT112作为其辅助因子可增强WBSCR22的抑癌作用。机制上WBSCR22高表达可下调致癌因子干扰素刺激基因15(ISG15)翻译,逆转ISG15的致癌作用。
m7G修饰在肿瘤免疫微环境中的作用
近年来,肿瘤微环境(TME)在肿瘤发生发展中的作用受到广泛关注。TME与肿瘤发生、免疫逃逸、免疫耐受和耐药性密切相关,是肿瘤细胞、癌相关成纤维细胞(CAF)、内皮细胞、脂肪细胞和其他类型免疫细胞发育的内部环境。
越来越多研究发现m7G修饰及其相关调控因子在TME中起着重要作用。早幼粒细胞白血病蛋白(PML)是一种肿瘤抑制蛋白,在TME中起重要作用。肺癌中WDR4通过泛素化通路降解PML,并通过HIF-1上调其下游CD73、尿激酶型纤溶酶原激活物受体(uPAR)和血清淀粉样蛋白A2(SAA2),这三种蛋白可通过多种机制建立促转移的肿瘤微环境。同时WDR4/PML轴可以减少CD8+ T细胞并增加TME中的Treg和M2巨噬细胞。M2巨噬细胞是源于单核细胞的独特亚群,与M1不同,M2可以分泌多种免疫抑制细胞因子,如IL-10和TGF-β以产生免疫抑制。Treg细胞主要来源于胸腺,具有免疫抑制作用。TME通过诱导肿瘤浸润Treg细胞中的PD-1表达来抑制CD8+ T细胞的免疫应答,从而促进肿瘤细胞免疫逃逸。在HNSCC中,METTL1敲除改变了TME中免疫细胞组成以及其与肿瘤细胞的通讯方式。在METTL1基因敲除小鼠中,CD4+ T和CD8+ T细胞显著上调,Treg和Th17细胞显著降低。白细胞介素1(IL1b)-白细胞介素1受体2(IL1r2)和白细胞介素1受体1(IL1r1)抑制间质细胞和上皮细胞受体-配体致癌通路。在肾上腺皮质癌中,免疫荧光显示METTL1在肿瘤细胞中高表达与CD8 +T细胞成反比,与巨噬细胞浸润率成正比。许多生物信息学分析也表明,m7G修饰相关调控因子以及LncRNA对TME有重要影响。
m7G修饰与肿瘤耐药性
尽管已经开发出许多治疗癌症的药物,但它们对治疗的耐药性和低患者存活率仍然令人沮丧。近年来越来越多研究揭示了m7G修饰和相关调控因子与癌症耐药性相关,总结如下(表2)。通过调节结肠癌(CC)中的miR149-3p/S100A4/P53轴,增加METTL1可促进顺铂对结肠癌细胞的致死作用。相反WBSCR22过表达降低了结肠癌细胞中奥沙利铂诱导的细胞内活性氧(ROS)和8-oxoguanine(8-oxoG)产生,导致对奥沙利铂治疗敏感性降低。在肝细胞癌中,METTL1/WDR4复合体通过调节m7G tRNA修饰促进EGFR通路基因翻译,从而降低肿瘤对仑伐替尼(Lenvatinib)的敏感性。敲除METTL1可以提高Hela细胞对5-氟尿嘧啶的敏感性。METTL1和WDR4通过改变肿瘤微环境来驱动耐药性。先前研究表明,TME与耐药性有关,可能是因为TME动态变化使得化疗药物靶向信号通路发生变化并失去其最初的致死作用。在鼻咽癌中,METTL1通过WNT/β-catenin信号通路增加EMT转化,导致体外和体内对顺铂和多西紫杉醇化疗耐药。WDR4还通过增强CCNB1翻译和EMT转化来降低肝细胞癌细胞对索拉非尼的敏感性,揭示了METTL1和WDR4在介导癌症耐药性中的重要作用,并有望成为未来的治疗靶点。
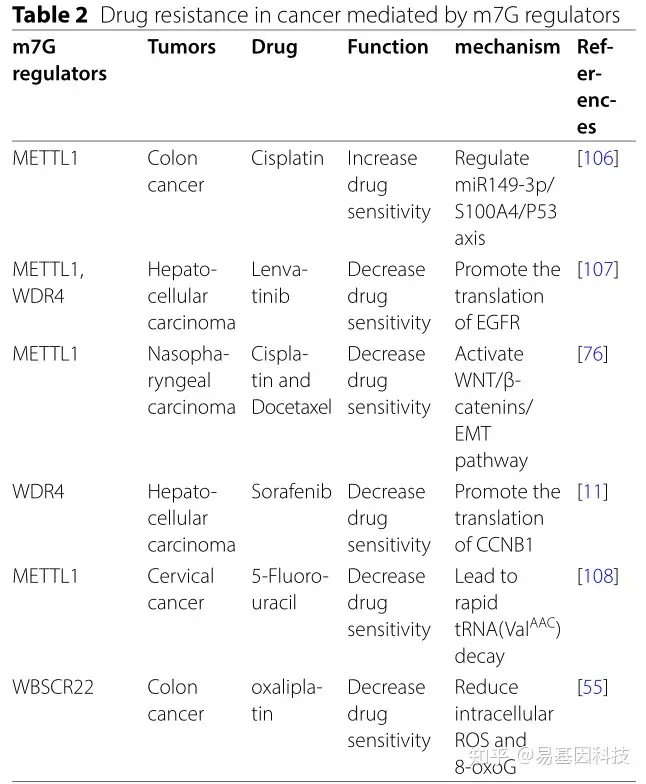
表2:m7G调控因子介导癌症耐药性
结论和未来方向
本文综述了m7G修饰和相关甲基转移酶在调控RNA转录、剪接、出核、翻译和相关生物过程中的作用,并描述了m7G修饰调节癌症发生机制,表明m7G修饰及其调控因子是未来癌症治疗的重要干预靶点。
METTL1/WDR4表达在大多数癌症中异常升高,通过增强m7G-tRNA表达,核糖体悬浮液减少,相关致癌基因mRNA翻译效率提高,下游致癌信号通路如PI3K/AKT和MAPK被激活,与此同时抑癌基因也在下降。m7G甲基化是肿瘤生长的双重调控因子,METTL1上调在CC畸形瘤中显示出抑癌作用,但在HCC、ICC、HNSCC、NPC、BC、LC、ESCC、NBL和神经胶质瘤中具有显著促癌作用;WBCCR22也是既抑制PC又促进神经胶质瘤。m7G修饰在同一肿瘤中具有矛盾的双重作用。在肺癌中,METTL1通过miRNA下调癌基因发生,同时通过AKT/mTORC1信号通路促进肿瘤细胞增殖,表明METTL1对肺癌同时具有正调控和负调控作用,但最终通过复杂的机制表现出促癌作用。
mRNA 5’端不仅存在m7G修饰,还包括m6A、m6Am和Am等组合RNA修饰。它们彼此靠近,可以相互影响。Am通常通过甲基转移酶磷酸化CTD互作因子1(PCIF1)以m7G帽依赖性方式转化为m6Am,会产生动态和可逆的表观转录组修饰。m6Am可以通过去甲基化酶FTO以m7G修饰依赖方式转换回Am。表明转录后修饰是调节体内生理过程复杂机构网络的一部分。除了与m6Am修饰的动态关联外,m7G是否也能与其他修饰配合,还需要进一步探索和研究。
除了参与癌症耐药性外,m7G修饰还介导癌症对其他治疗的耐药性。肝癌的放疗抗性由METTL1表达增加引起。在放疗后,METTL1改善了DNA依赖性蛋白激酶催化亚基或DNA连接酶IV翻译,从而加速了非同源末端连接(NHEJ)介导的DNA双链断裂修复。此外,METTL1在射频消融后HCC组织通过m7G-tRNA调控下游SLUG/SNAIL信号通路,增加HCC的恶性程度,也许常规癌症治疗与特异性METTL1抑制剂相结合可以达到更好的治疗效果。
目前,m7G修饰及其相关调控因子的研究仍存在诸多局限。由于m7G是近年来新发现的RNA修饰,参与这一过程的去甲基化酶(eraser)、甲基化阅读蛋白(reader)和其他甲基转移酶(writer)尚未被鉴定。由于m7G数据库的创建,研究人员已经预测了一些与m7G修饰相关的调控因子,但仍需要进一步的实验验证其是否参与m7G修饰形成。
由于技术限制,miRNA中是否存在m7G甲基化位点仍存在争议,因此迫切需要开发新的高分辨率测序工具来帮助更好了解RNA中的m7G修饰谱。近年来RNA中的m7G位点已经被几个Web服务器模拟,包括iRNA-m7G、XG-m7G、m7G-IFL、m7GFinder、m7G-DPP和m7GPredictor,这将有助于更快更新m7G内部网络。
未来的研究将集中于m7G修饰在TME中的作用,这将有助于提高癌症免疫疗法的有效性和应答率。M2巨噬细胞、髓源性抑制细胞(MDSCs)和Treg细胞是TME中主要的免疫抑制细胞,通过分泌多种抑制因子来限制免疫应答。Liu等人已经证明,在ICC小鼠模型中,靶向METTL1介导的tRNA修饰减少了多形核髓源性抑制细胞(PMN-MDSCs)并提高抗PD-1疗效。关于HNSCC中IL1b-IL1R1信号的抑制作用,Mair等证实Treg在HNSCC肿瘤微环境中显著增加。与IL1R1 Treg相比,肿瘤浸润性Treg细胞选择性表达IL1R1受体,标志着Treg细胞的高度抑制和扩大,更有效抑制CD8+ T细胞。可能表明m7G修饰通过这一机制调控HNSCC肿瘤微环境,但仍需进一步实验来证明。迄今为止尚无m7G修饰的靶向抑制剂,鉴于m7G修饰在肿瘤治疗中的巨大潜力,相关药物出现有望提高靶向药物联合免疫治疗的疗效。总之,m7G修饰为肿瘤发生发展机制的研究提供了新思路,对肿瘤诊断、预后和治疗具有重要作用,值得进一步研究。
易基因科技提供全面的RNA甲基化研究整体解决方案,详询易基因:0755-28317900。
参考文献:Zhang X, Zhu WY, Shen SY, Shen JH, Chen XD. Biological roles of RNA m7G modification and its implications in cancer. Biol Direct. 2023 Sep 14;18(1):58. pii: 10.1186/s13062-023-00414-5. doi: 10.1186/s13062-023-00414-5. PubMed PMID: 37710294.
相关阅读:
技术推介|RNA m7G甲基化测序(m7G-MeRIP-seq)
深度综述:m5C RNA甲基转移酶及其在癌症中的潜在作用机制