大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近年来,5-甲基胞嘧啶(m5C)RNA修饰已成为通过编码和非编码RNA调控RNA代谢和功能的关键参与者。越来越多的证据表明,m5C可以调控RNA稳定性、翻译、转录、出核和切割,以及介导细胞增殖、分化、凋亡、应激反应和其他生物学功能。人的m5C RNA修饰由NOL1/NOP2/sun(NSUN)家族和DNA甲基转移酶2(DNMT2)催化。这些RNA修饰因子调控多种致癌基因fizzy-related-1、forkhead box蛋白C2、Grb相关结合蛋白2、TEA结构域转录因子1的表达,以促进癌症的发病和进展机制。此外,甲基转移酶的异常表达已在各种癌症中得到鉴定,并用于预测患者预后。本综述对m5C RNA甲基转移酶进行全面综述,特别强调了m5C在癌症中的潜在作用机制,最后讨论了m5C相关研究前景。
介导m5C的RNA甲基转移酶
人的RNA m5C甲基化主要由NOL1/NOP2/sun家族和DNMT2催化,这对RNA稳定性和功能非常重要。甲基转移酶通过S-腺苷甲硫氨酸(S-adenosylmethionine)作为甲基供体形成m5C将甲基转移到胞嘧啶中。不同细胞区室具有引起修饰的固有酶。在细胞核中,mRNA、tRNA、28S rRNA和非编码RNA的m5C主要由NSUN2、NSUN5、NSUN6、NSUN7和NOP2甲基化。在线粒体中,NSUN2和NSUN3甲基化tRNA,NSUN4甲基化12S rRNA,以促进线粒体核糖体组装(表1和图1)。
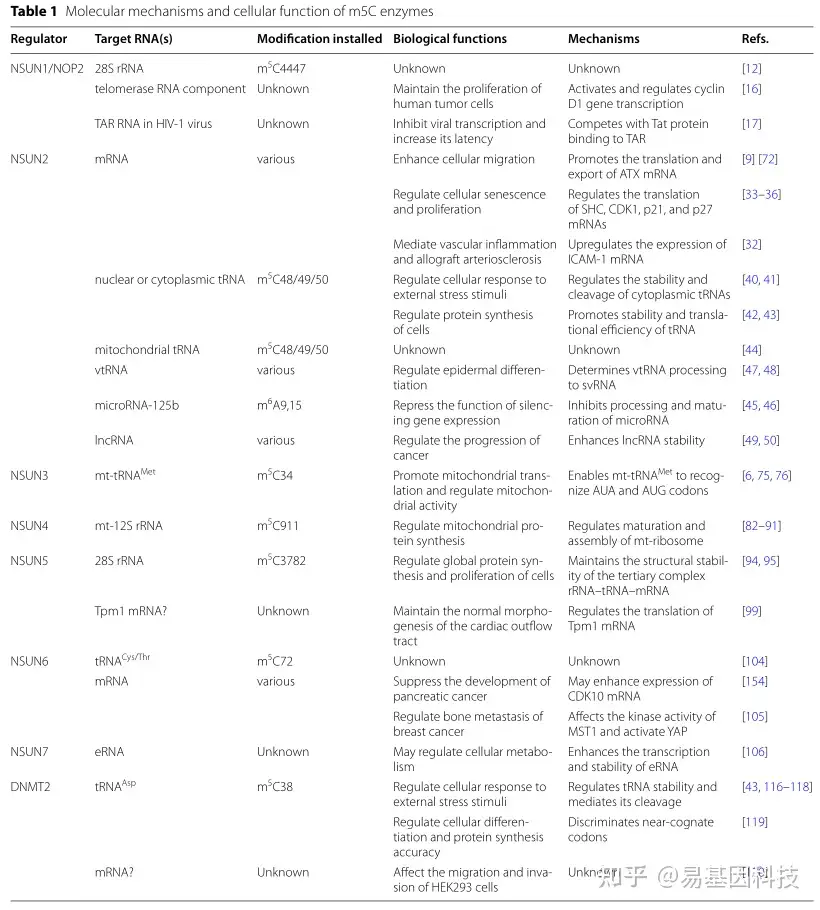
图1:m5C甲基转移酶的分子机制和功能。mRNA(A)、tRNA(B)、rRNA(C)和非编码RNA(D)m5C修饰,如lncRNA、microRNA、vtRNA和eRNA。m5C修饰的RNA可以调控RNA分子功能并介导细胞代谢
NOP2
NOP2(Nucleolar protein 2,也称为NSUN1),参与28S rRNA 4447胞嘧啶位点(C4447)的甲基化。NOP2在胚胎植入前调控核仁成熟,从而促进胚泡形成并参与核糖体生物发生,为哺乳动物胚胎发育所必需。rRNA加工需要NOP2而非m5C修饰活性,此外NOP2在神经组织再生过程中促进细胞增殖。在人的肿瘤细胞中,NOP2通过其rRNA甲基转移酶结构域与端粒酶RNA组分(TERC)结合,从而激活和调控细胞周期蛋白D1(cyclin D1)基因转录,维持细胞增殖。在HIV-1病毒中,NOP2在5'-长末端重复序列(LTR)上与TAR RNA结合导致m5C添加,从而通过与TAT蛋白竞争抑制病毒转录并促进其潜伏性。
NOP2可通过microRNA PVT1上调,以促进肝细胞癌(HCC)增殖和前列腺癌转移。NOP2在肾透明细胞癌、肺腺癌、结直肠癌和低级别胶质瘤等多种癌症中也存在异常表达,提供了与m5C甲基化相关的风险信号,有助于确定患者预后。
NSUN2
NSUN2主要位于细胞核中,是c-MYC的直接靶点,通过招募核仁和纺锤体相关蛋白(NuSAP)来稳定快速分裂细胞中的有丝分裂纺锤体,并将m5C添加到mRNA和几种非编码RNA中。
由于靶点众多,NSUN2在几个过程中发挥着重要作用,包括调节增殖、应激反应和代谢、迁移和分化以及衰老过程中的细胞功能。NSUN2与自闭症谱系障碍、抑郁症、Dubowitz综合征、智力障碍等许多疾病相关,并在各种癌症中差异表达。近年来,一些研究探索了其分子机制,构建了预后模型,并试图寻找癌症治疗的新靶点。目前,关于NSUN2在生物学功能和癌症机制方面的调控研究主要集中在mRNA修饰上。NSUN2诱导的ncRNA修饰与mRNA和蛋白质互作通路还有待进一步研究和探索。此外尽管尚未讨论,tRNA切割影响细胞应激反应的机制可能对进一步理解癌症具有重要潜力。
NSUN3
在线粒体中,NSUN3介导34位胞嘧啶(C34)的mt-tRNAMet甲基化为m5C34,m5C34进一步被ALKBH1/ABH1氧化为f5C34。f5C34使mt-tRNAMet能够识别编码甲硫氨酸的AUA和AUG密码子。NSUN3敲除和突变细胞表现出线粒体蛋白质合成减少和耗氧量减少,导致线粒体功能障碍。NSUN3中的双等位基因错义突变导致早发性线粒体脑肌病和癫痫发作。NSUN3基因突变可能会对神经系统造成损害。Trixl等人证明了NSUN3失活对小鼠胚胎干细胞自我更新和分化潜力的影响。
已有研究表明,NSUN3在几种癌症中表达上调,并与免疫细胞浸润相关,其过表达可能参与调节细胞对化疗药物敏感,从而影响患者预后。
NSUN4
NSUN4是一种双功能蛋白,参与12S rRNA胞嘧啶位点911(m5C911)的甲基化,并与MTERF4互作以促进单体组装。尽管其机制尚不清楚,但m5C911可能与附近m4C909和其他rRNA修饰协同稳定12S rRNA折叠,从而促进mt核糖体组装。
NSUN4表达影响胚胎发育和线粒体蛋白质合成。小鼠NSUN4基因的种系敲除具有胚胎致死性,心脏中的条件敲除会中断线粒体蛋白翻译,导致呼吸复合体形成受损。
NSUN4在肺腺癌、肝细胞癌和肾透明细胞癌中异常表达,可用于预测预后。
NSUN5
NSUN5在人28S核糖体RNA的C3782引入m5C。哺乳动物NSUN5缺失会改变核糖体,影响总蛋白质合成,从而影响细胞大小和增殖。这可归因于m5C3782对三级rRNA-tRNA-mRNA复合体的维持。
NSUN5还影响神经系统的发育和功能。其缺失与Williams–Beuren综合征(WBS)相关。NSUN5的表达对大脑皮层的发育至关重要,它通过调节视网膜神经节细胞的放射状神经胶质支架来调控新皮质神经元的迁移。NSUN5缺失干扰新皮质神经元的层状结构和锥体细胞发育,导致少突胶质细胞前体细胞增殖减少和髓鞘减退,从而导致胼胝体(CC)发育不全和海马锥体细胞中NMDA受体(NMDAr)功能障碍。此外,在心血管系统中,NSUN5介导的m5C修饰对于维持Tpm1表达至关重要,Tpm1是正常心脏流出道(OFT)形态发生的重要基因,表明NSUN5参与法洛四联症(TOF)发生。
NSUN5在头颈部鳞状细胞癌(HNSCC)中显著上调,并通过触发细胞周期阻滞作为结直肠癌(CRC)的启动子。在胶质瘤中观察到其表观遗传学失活,并表现出肿瘤抑制特征。
NSUN6
NSUN6对mRNA具有较强的底物特异性,主要靶向位于发夹结构环内的共有序列motif CTCCA上的3' UTR区域的m5C修饰。NSUN6靶向的CTCCA motif标志着翻译终止。3'UTR甲基化发夹结构可能导致翻译终止,但没有证据证实这一观点。在人HEK和H9细胞系中,NSUN6主要靶向编码RNA和蛋白结合蛋白的mRNA。NSUN6介导的m5C修饰可提高mRNA丰度和翻译效率,还可以促进tRNACys和tRNAThr的3 '端受体的胞嘧啶72 (C72)甲基化,目标识别依赖于3′-CCA尾巴。
在NSUN6高表达的肿瘤组织中,NSUN6 mRNA水平下调;而在NSUN6低表达的肿瘤组织中,RNA水平没有差异。NSUN6还被证明通过m5C修饰使巨噬细胞刺激1 (macrophage stimulating 1, MST1)失活,并激活乳腺癌yes相关蛋白(yes-associated protein, YAP)靶基因,从而触发破骨细胞分化和骨转移。对mRNA m5C甲基转移酶,利用生物信息学分析了NSUN2和NSUN6之间的相关性,分析结果揭示了分别在肾癌、三阴性乳腺癌和皮肤黑色素瘤中呈正相关、不相关和负相关。然而迄今为止所有的研究都没有提供直接的证据来支持这两种酶之间的相关性。此外,还没有检测到可以识别mRNA上依赖NSUN6的m5C位点的reader,这影响进一步了解NSUN6在细胞代谢和癌症进展中的调节作用。
NSUN7
NSUN7和过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)互作以促进空腹相关基因的转录。同时,NSUN7通过m5C修饰增强eRNA稳定性,并可能参与细胞代谢的调节。
此外,NSUN7突变可导致精子质量受损和不育。这可能是由外显子7的转位突变,从而影响蛋白质结构和配体结合位点。然而,这种突变与中国汉族男性的弱精子症无关。此外,NSUN7还与精神疾病相关,可用于尤因肉瘤、低级别神经胶质瘤和前列腺癌症患者的预后。
DNMT2
与DNMT1、DNMT3a、DNMT3b等其他DNA甲基转移酶相比,DNMT2仅由C端催化结构域组成,而缺乏N端调控结构域。DNMT2(也称为TRDMT1)不具有DNA催化活性,但可将m5C38引入tRNAAsp (GUC)。
DNMT2介导的m5C修饰提高了tRNA稳定性,其中tRNAAsp在果蝇的热休克反应中无需核糖核酸酶切割,在小鼠中无需片段化。此外,DNMT2通过m5C影响蛋白质合成的表达和精度,DNMT2介导的tRNAAsp-m5C38调节poly-Asp序列的蛋白质翻译。小鼠天冬氨酰-tRNA合成酶对C38甲基化tRNAAsp表现出4-5倍的偏好。DNMT2还通过区分近同源密码子来确保肽的精确合成,为细胞分化和蛋白质合成所必需。同时还参与mRNA甲基化调控,影响HEK293细胞的迁移和侵袭。
DNMT2参与调节细胞应激反应。在应激条件下,DNMT2定位于细胞质应激颗粒和RNA加工小体。DNMT2沉默导致氧化应激增强、基因组不稳定、细胞增殖永久性抑制、端粒长度和端粒酶活性降低、整体RNA高甲基化以及与增殖和肿瘤抑制相关的多种miRNA上调。
m5C RNA甲基转移酶在癌症中的潜在作用
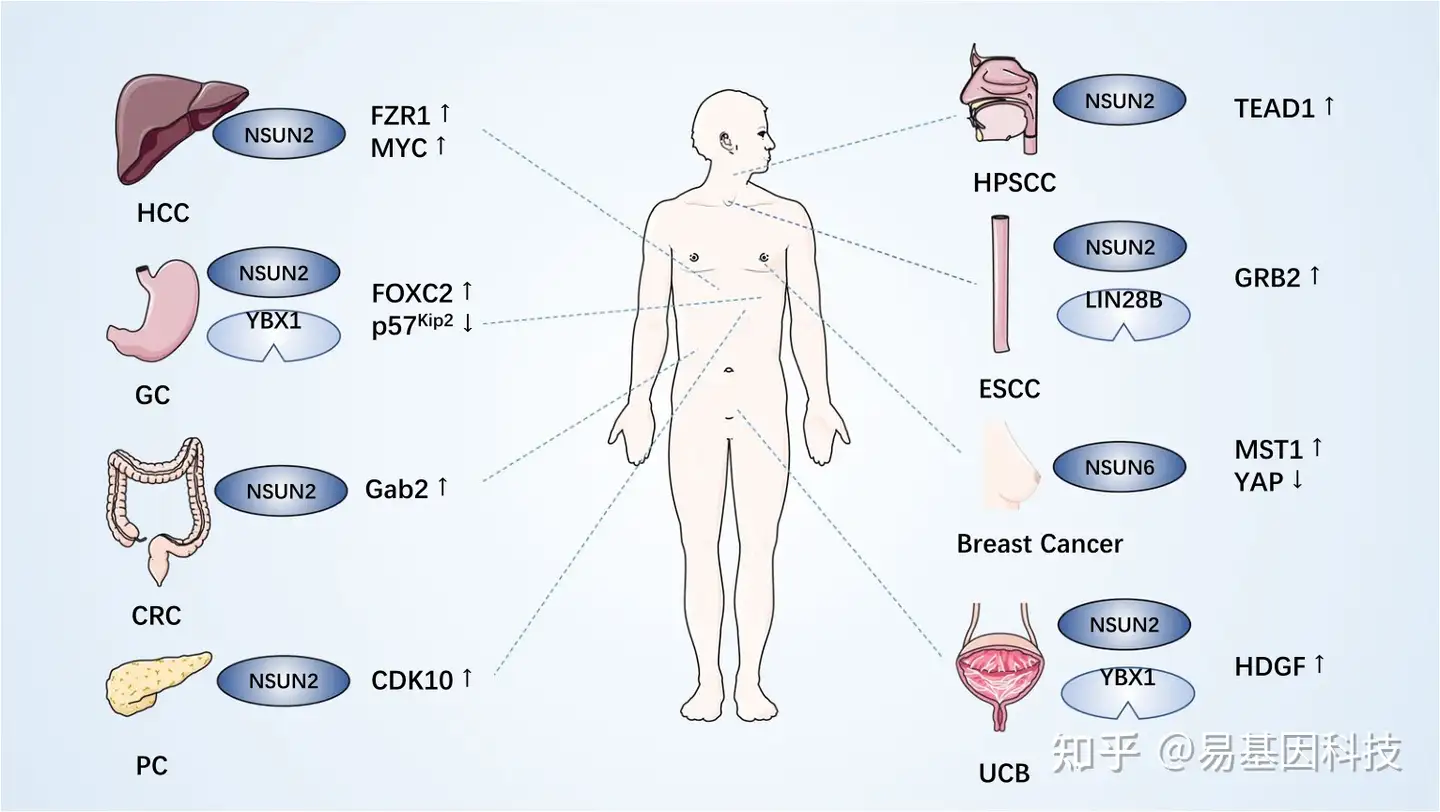
m5C甲基转移酶(尤其是NSUN2)通过催化靶RNA的m5C修饰来调节底物水平,介导一系列致癌或抗肿瘤因子的交联,从而影响肿瘤发生和癌症进展。以下详细阐述了m5C甲基转移酶在癌症中的异常表达和相应机制(表2和图2)。
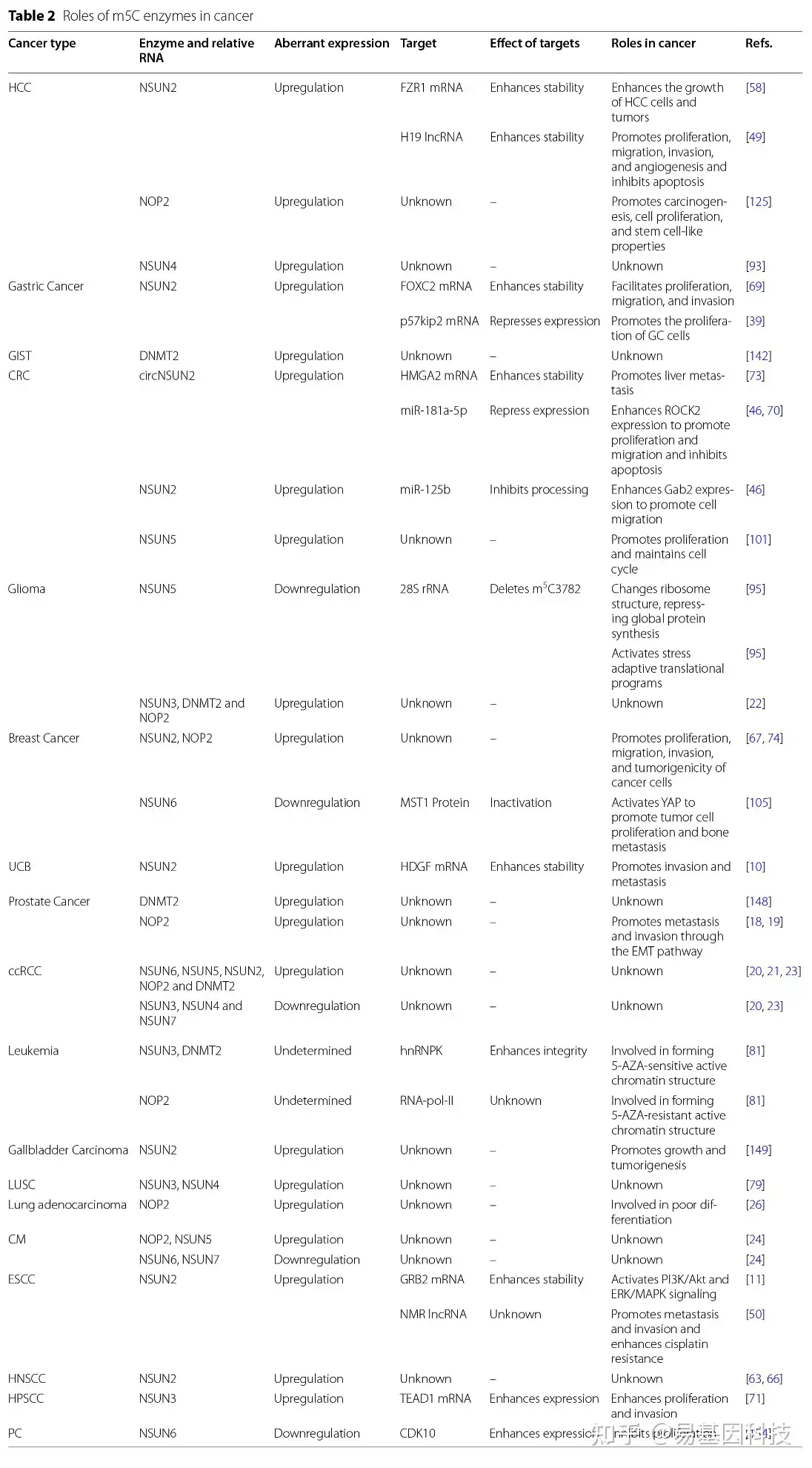
肝细胞癌(Hepatocellular carcinoma)
在肝细胞癌(hepatocellular carcinoma, HCC)中,m5C调控基因的突变频率较高,m5C相关基因的失调与HCC的高分期相关。在HCC细胞中,lncRNA-PVT1与NOP2结合,通过稳定性增强上调其表达,hPVT1/NOP2/细胞周期通路促进肿瘤发生、细胞增殖和干细胞样特性。靶向该通路可能在HCC中具有治疗潜力。
NSUN2在HCC细胞中的转录水平上调,促进肝癌细胞的增殖、迁移、侵袭和血管生成,并抑制HCC细胞凋亡。NSUN2增加了fizzy-related-1 (FZR1) mRNA的稳定性,从而调节FZR1表达,导致HCC细胞和肿瘤生长增强。FZR1是后期促进复合体或环体的共激活因子。FZR1作为E3泛素连接酶,可以调节有丝分裂和细胞周期的G1期。最近研究发现FZR1参与调控结直肠癌、乳腺癌、急性B淋巴细胞白血病和多发性骨髓瘤。NSUN2沉默抑制FZR1,诱导HCC细胞周期阻滞并增加细胞凋亡。NSUN2-KO细胞抑制胃癌细胞中FZR1的表达,这与HCC一致。但NSUN2-FZR1在HCC迁移和侵袭中的作用尚不清楚。此外,NSUN2在H19 lncRNA上引入m5C986以增强其稳定性。NSUN2缺失显著降低H19 RNA的半衰期。H19 RNA的m5C修饰增强了其与肿瘤蛋白G3BP1的特异性结合,G3BP1与MYC mRNA结合并促进其衰变。相反,m5C修饰的H19 RNA可能与MYC mRNA竞争结合G3BP1,导致MYC积聚并促进HCC细胞发展。H19高表达和m5C修饰与HCC低分化相关。
此外,NSUN4和m5C识别蛋白(reader)ALYREF在HCC中上调,并与不良预后相关。
胃肠道肿瘤(Gastrointestinal cancer)
生物信息学分析显示,所有m5C调控因子(除NSUN6外)在胃肠道肿瘤(GI)的病理分期为I至IV期的患者中的表达水平显著上调,且除NSUN7外,m5C调控因子与较短的总生存期(OS)相关。m5C调控因子对ErbB和PI3K-Akt信号通路影响最大,BSK3B是m5C调控因子的重要潜在靶点。
在胃肠道肿瘤中,NSUN2突变率最高。在胃癌(GC)细胞中,小泛素样修饰蛋白(SUMO)-2/3与NSUN2蛋白互作,促进其稳定并介导其入核。NSUN2通过m5c依赖和非依赖通路促进肿瘤进展。NSUN2被lncRNA forkhead box蛋白C2 (FOXC2)-AS1招募,以m5c依赖方式修饰FOXC2 mRNA。m5C识别蛋白YBX1与甲基化FOXC2 mRNA结合增强其稳定性,从而促进胃癌细胞的增殖、迁移和侵袭。FOXC2作为一种致癌基因,在多种癌症中过表达,促进细胞增殖并诱导上皮-间充质转化(EMT)。此外,NSUN2通过在p57Kip2 mRNA的3-UTR引入m5C修饰,影响了p57Kip2转录稳定,从而抑制其表达并促进胃癌细胞增殖。p57kip2是CIP/Kip家族的CDK抑制剂,参与多种生物学过程,在胃癌中作为抗肿瘤因子发挥作用,并在多种癌症中下调。此外,在NSUN2-KO GC细胞中,PIK3R1和PCYT1A mRNA表达下调,m5C peaks减少。对TCGA数据集的生物信息学分析显示,磷脂酰肌醇-3激酶调节亚基1 (PIK3R1)和磷酸胞苷酰转移酶1A (PCYT1A)的高表达与胃癌(GC)的不良预后相关。
此外,与癌旁组织相比,DNMT2在成人胃肠间质瘤(GIST)中显著过表达。
结直肠癌(Colorectal cancer,CRC)
环状RNA (Circular RNAs, circRNAs)是一类通过反向剪接产生的非编码RNA。Circ NSUN2、NSUN2和NSUN5在CRC中上调并促进其进展。circNSUN2过表达促进CRC细胞转移、迁移和增殖,并抑制肿瘤细胞凋亡。由YTH结构域1(YTHDC1)以m6A依赖性方式介导,circNSUN2从细胞核出核到细胞质,高水平circNSUN2通过形成circNSUN2/胰岛素样生长因子2 mRNA结合蛋白2(IGF2BP2)/HMGA2 RNA-蛋白三元复合蛋白来增强HMGA2(high-mobility group AT-hook 2 )mRNA稳定性,导致CRC的肝转移(LM)。此外,circNSUN2作为miRNA海绵靶向miR‑181a‑5p并下调其表达。致癌基因Rho相关卷曲螺旋蛋白激酶2(ROCK2)被miR‑181a‑5p下调。circNSUN2介导的miR‑181a‑5p对ROCK2负调控抑制促进CRC细胞的增殖和迁移,并抑制其凋亡。此外,circNSUN2靶向miR-296-5p并被alopperine(ALO)下调,从而上调CRC中miR-296-5 p的异常低表达。miR-296-5p与STAT3结合并抑制其表达,从而抑制CRC细胞的增殖并促进其凋亡。CircNSUN2沉默抑制CRC细胞增殖,其可以被miR296-5p抑制剂中和。ALO通过调控circNSUN2/miR-296-5p/STAT3通路以预防结直肠癌。
在癌症标本中,NSUN2被蛋白质活化受体2(PAR2)和甲基化前mir-125b以m6A依赖方式激活,干扰其加工,从而降低mir-125b水平。Grb相关结合蛋白2(Gab2)介导细胞迁移,其被miR-125b抑制。miR-125b抑制增强了Gab2表达,从而促进细胞迁移。
NSUN5在CRC组织和细胞中上调。NSUN5-KO小鼠表现出细胞增殖的显著减少和诱导的细胞周期停滞。GSEA提示NSUN5可能通过Rb-CDK信号通路促进癌症细胞增殖。
神经胶质瘤(Glioma)
在低级别胶质瘤中,DNA和RNA的几种m5C调控因子上调,包括NSUN3、TET2、DNMT2、ALYREF、DNMT3b、DNMT1、NOP2和NSUN2。此外,多种m5C调控因子与总生存期(OS)相关。NSUN4、NSUN7、DNMT1、DNMT3b、DNMT3a、NOP2和NSUN5与OS呈负相关,而NSUN6与OS呈正相关。在此基础上,构建了一个由NSUN7、DNMT1、NSUN4和NSUN6组成的预后模型。
在人神经胶质瘤细胞系U87中,NSUN2通过调控自分泌趋化因子(ATX)-溶血磷脂酸(LPA)轴介导肿瘤细胞迁移。NSUN2在 ATX mRNA 3'-UTR的胞嘧啶2756位点甲基化,从而增强ATX mRNA翻译。ATX-LPA通路介导癌症细胞迁移。此外,ALYREF与甲基化的ATX mRNA互作,促进其从细胞核出核到细胞质。NSUN2-KO抑制U87细胞迁移,加入LPA后可回复迁移。
在体内神经胶质瘤模型中,NSUN5显示CpG岛启动子区高甲基化,导致转录本减少和表观遗传学沉默。NSUN5沉默诱导了28S rRNA C3782位点甲基化缺失。在应激条件下,非甲基化状态导致蛋白质合成的全面耗竭,同时激活特定的mRNA翻译程序,导致NAD(P)H-醌脱氢酶1(NQO1)蛋白上调。NQO1过表达导致对NQO1靶点药物敏感。因此,NSUN5表观遗传学沉默是胶质瘤的一个保护因子,与更好预后相关。
乳腺癌(Breast cancer)
在乳腺癌细胞和组织中,NSUN2 DNA低甲基化导致NSUN2 mRNA和蛋白过表达。NSUN2上调促进乳腺癌细胞的增殖、迁移和侵袭,而NSUN2-KO抑制这些过程。在三阴性乳腺癌(TNBC)中,NSUN2表达上调,从而作为致癌因子;而NSUN6表达下调,作为抑癌因子。NSUN2和NSUN6影响乳腺癌的致瘤性和肿瘤免疫微环境(TIM)。此外,NSUN2和NOP2 mRNA的上调与乳腺癌患者较短的无病生存期显著相关。
而李春来等研究表明NSUN6促进乳腺癌骨转移,HER3被酪氨酸激酶(RTK)样孤儿受体1 (ROR1)磷酸化。NSUN6被p-HER3招募导致MST1甲基化,从而影响MST1激酶活性并激活YAP。YAP在细胞核中的激活核积聚刺激与肿瘤细胞增殖和骨转移相关的靶基因表达。
泌尿系肿瘤(Urinary tumor)
在膀胱尿路上皮癌(UCB)中,NSUN2和m5C识别蛋白YBX1表达上调,与UCB的T/N分期、肿瘤分级和患者较差的无病生存期呈正相关。NSUN2将m5C引入HDGF mRNA的3’UTR中,YBX1进一步招募ELAV1以稳定m5C修饰的mRNA以调控HDGF表达。NSUN2-KO和YBX1-KO T24细胞的侵袭和转移能力显著降低。HDGF作为多种癌症的致癌基因,已被证明可促进癌症侵袭。
在前列腺癌中,NOP2表达上调,通过EMT通路促进前列腺癌转移和侵袭。NOP2是miR-PVT1和miR-542-3p的靶基因,由lncRNA LINC00963间接调控。此外,DNMT2在肿瘤细胞中的表达水平高于非肿瘤上皮细胞,在淋巴结转移灶中的表达水平高于原发癌。在接受雄激素消融治疗的患者中,DNMT2的表达也上调。
在肾透明细胞癌(ccRCC)中,肿瘤组织中NOP2和NSUN4的mRNA水平高于正常组织,而NSUN6和m5C eraser TET2的mRNA水平低于正常组织。4个m5C调节因子构成了决定患者预后的风险信号。肾透明细胞癌中NOP2高表达与低OS相关。另一项研究显示,NSUN5、ALYREF、DNMT3b、DNMT3A、NSUN2、NOP2和DNMT1在ccRCC中表达上调,而NSUN3、NSUN4、NSUN7和TET2表达下调。该研究提出了由7个m5C调控因子组成的风险信号标签:NOP2、NSUN2、NSUN3、NSUN4、NSUN5、TET2和DNMT3b。
其他癌症(Other cancers)
在胆囊癌(gallbladder carcinoma,GBC)中,NSUN2在细胞和组织中的表达均上调。NSUN2基因沉默可抑制GBC细胞的增殖和肿瘤发生,而NSUN2基因过表达可促进胆囊癌细胞生长。RPL6通过调节NSUN2 mRNA的翻译发挥致癌作用。在RPL6沉默细胞中,NSUN2蛋白水平降低,导致NSUN2 mRNA积累。
在肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)中,NSUN3和NSUN4表达上调并与不良预后相关。这些被用来构建预后风险信号。此外,NSUN3和NSUN4与6种主要免疫细胞浸润相关。在肺腺癌中,体外实验表明NOP2高表达或核糖核蛋白(heterogeneous nuclear ribonucleoprotein, hnRNP) 异质性细胞更可能与低分化相关。NSUN3区域缺失在非吸烟者肺腺癌中常见,发生率为15%。
在皮肤黑色素瘤(cutaneous melanoma,CM)中,DNMT2、NSUN3、NSUN6、YBX1和NOP2差异表达并用于计算患者的风险评分。特别是NOP2上调和NSUN6下调与黑素瘤进展密切相关。
在食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中,NSUN2过表达参与致癌作用。已知NSUN2受E2F转录因子1 (E2F1)正调控,并诱导生长因子受体结合蛋白2 (GRB2) mRNA的3'UTR发生m5C修饰。Lin-28同源B (LIN28B)识别GRB2修饰从而增强GRB2稳定性,通过GRB2上调激活PI3K/Akt和ERK/MAPK信号。另一项研究表明,NSUN2甲基化了一个新的lncRNA——NSUN2-甲基化lncRNA (NMR)。NMR促进食管鳞癌的转移和侵袭,并增强其对顺铂的耐药性,其机制可能与m5C修饰NMR抑制潜在mRNA甲基化相关。
在头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)中,NSUN2表达显著上调,与较短的OS以及细胞周期检查点相关基因的表达相关。NSUN2可能受Klotho (KL)调控,其低表达与KL高表达和KL-DNA低甲基化呈正相关。NSUN2表达与T细胞活化评分呈负相关。NSUN2低表达和T细胞活化评分高的患者死亡率较高。
在下咽鳞状细胞癌(hypopharyngeal squamous cell carcinoma, HPSCC)中,NSUN2的mRNA和蛋白水平均上调。NSUN2用m5C修饰TEA域转录因子1 (TEA domain transcription factor 1, TEAD1) mRNA的3'UTR,促进TEAD1表达,从而增强肿瘤细胞的增殖和侵袭。TEAD1协调并整合多个信号通路,其下调会影响多种癌基因的表达,这些癌基因参与调控肿瘤细胞的进展、转移和对化疗的耐药性。
在胰腺癌(pancreatic cancer,PC)中,NSUN6表达水平显著下调。过表达NSUN6可抑制胰腺癌细胞增殖并上调CDK10水平,提示NSUN6可能通过调控CDK10调控胰腺癌细胞生长。NSUN6高表达预示PC患者风险较低,预后较好。
m5C RNA甲基转移酶在癌症治疗中的应用
尽管目前还没有开发出m5C RNA甲基转移酶的特异性抑制剂,但多种化学物质可以与这些甲基转移酶互作以抑制癌症进展。有研究表明,阿扎胞苷可以抑制DNMT2催化的tRNAAsp的C38甲基化,从而降低癌症细胞的代谢活性。在乳腺癌细胞中,植物化学物质莱菔硫烷(sulforaphane, SFN)、熊果酸(ursolic acid, UA)和桦木酸(betulinic acid, BA)可以降低NOP2的表达,抑制细胞增殖,可能是由于干扰核糖体形成导致翻译效率降低。
m5C RNA甲基转移酶也参与调节癌症细胞的耐药性。在白血病中,RNA-m5C酶调节对5-阿扎胞苷(5-AZA)的敏感性和耐药性。在5-AZ敏感的白血病细胞(ASLC)中,NSUN3和DNMT2直接与hnRNP互作,hnRNP参与5-AZ敏感性染色质结构形成,该结构形成对这些蛋白质的完整性至关重要的复合蛋白。在5-AZA耐药白血病细胞(ARLC)中,NOP2、BRD4和RNA pol-II互作与形成对5-AZA具有耐药性的活性染色质结构有关,但对BRD4和NOP2抑制高度敏感。此外,NSUN2和另一种tRNA甲基转移酶甲基转移酶1 (METTL1),通过甲基化稳定tRNA,预防RTD,从而增强癌症细胞对5-氟尿嘧啶(5-FU)的耐药性,但Aurora-B对NSUN2的磷酸化会导致其酶活性降低。在胶质母细胞瘤中,NSUN2是NRF1(nuclear respiratory factor 1)的靶基因,其高表达与替莫唑胺(temozolamide,TMZ)治疗耐药性有关。在黑色素瘤中,NSUN5表达上调可用于预测黑色素瘤细胞对吡嗪衍生物c-Src抑制剂10a的敏感性。
DNMT2还参与调节与化疗诱导衰老相关的对癌细胞的不良效应。
结论
本综述总结了m5C RNA甲基转移酶的分子机制和生物学意义,并讨论了其在癌症中的潜在作用。m5C RNA甲基转移酶是将m5C引入多种RNA的修饰因子。在mRNA中,m5C修饰可以调控稳定性并介导出核和翻译,而在ncRNA中,m5C修饰影响其稳定性、加工、切割、转录和翻译。这些分子功能/过程的下游作用进一步介导各种细胞功能的调节,包括细胞增殖、分化、迁移、衰老、应激反应和炎症。同时,m5C RNA甲基转移酶也参与m6A催化,与m5C具有组合效应。总之,m5C甲基转移酶是转录后的重要调控因子,其对癌症的调控机制、预后功能和靶向治疗的研究强调了其临床应用的潜力和可行性。
尽管近年来m5C RNA甲基转移酶在癌症中的功能成为许多研究的焦点,但其认识仍远不完整。目前尚无研究探讨m5C甲基转移酶之间的互作网络,这可能导致癌症中关键通路的调控机制被忽略。此外,一些m5C位点的特异性功能如NSUN2和NSUN6对tRNA甲基化以及NOP2对28S rRNA甲基化,尚未确定。目前研究大多集中在mRNA上,但NSUN5对rRNA的修饰以及NSUN2对lncRNA和miRNA的修饰表明非编码RNA m5C修饰在癌症发展中的潜力。对于具有多种底物的RNA甲基转移酶,很难通过单基因沉默实验来鉴定哪种RNA修饰引起表型变化,需要更精确的实验设计来阐明其功能。此外,应该仔细检查m5C修饰的的reader和eraser。与m6A修饰相比,目前对m5c相关调控因子的认识还很欠缺,难以全面描述其生物学过程和功能。在mRNA中,m5C水平(0.02-0.09%)低于m6A水平(0.4-0.7%),需要开发出对m5C的更灵敏和更可靠的检测方法。目前还尚未开发出特异性m5C RNA甲基转移酶抑制剂作为抗肿瘤药物。
尽管m5C RNA甲基转移酶的研究有助于揭示RNA甲基化的机制和作用,但深入了解癌症的发病机制和发展对于有效评估和治疗患者至关重要。在此基础上,未来关于m5C RNA甲基转移酶的研究将涉及以下4个方面:
- 检测肿瘤中m5C甲基转移酶的异常表达并构建风险评分以评估患者生存率;
- 探索m5C RNA甲基转移酶的靶点,构建由相关分子通路组成的调控交联模型;
- 开发与m5C相关的靶向治疗,为癌症治疗提供新的潜在选择;
- 开发适用于mRNA的高精度和通用的m5C检测测序技术。
关于易基因RNA m5C甲基化测序(RNA-BS)技术
m5C是RNA百余种修饰中研究较多的一种。m5C存在于tRNA上时,可以对翻译进行调节;存在于rRNA上时,可以对核糖体的生物合成进行质控;存在于mRNA上时,则可以影响mRNA的结构、稳定性及翻译过程。
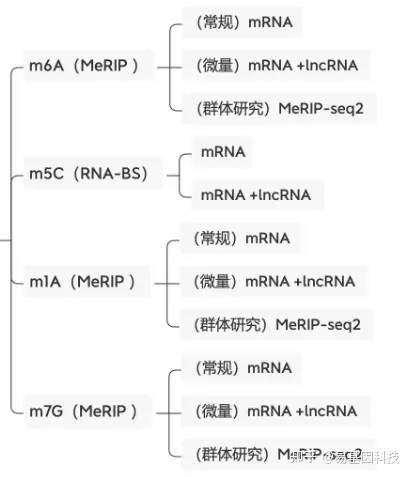
易基因提供适用于不同科研需求的m5C甲基化测序技术:
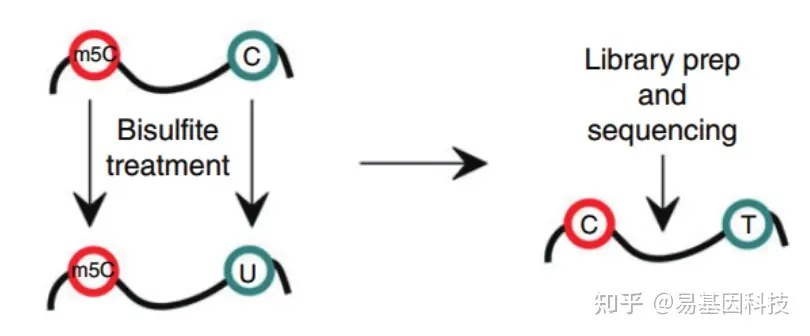
- 常规mRNA m5C甲基化测序(RNA-BS):
mRNA分离后首先通过亚硫酸盐处理,非甲基化的C转变为U,m5C修饰的碱基保持不变,结合高通量测序,可以对RNA上的每一个C碱基修饰进行定位与定量。 - 常规mRNA +lncRNA m5C甲基化测序(全转录组RNA-BS):
易基因科技建立的升级版m5C RNA甲基化测序服务,去除人rRNA后,剩余RNA经重亚硫酸盐处理后,结合高通量NGS策略,可在全转录组范围内单碱基分辨率地检测基因m5C甲基化修饰分布。
技术优势:
- 高深度:超高深度重亚硫酸盐处理,检测准确性极高;
- 高通量:结合高通量NGS,全转录组范围内检测;
- 单碱基:单碱基分辨率,快速检测和分析RNA中的m5C。
- 高准确:精确的检测mRNA等每一个C碱基的的修饰水平。
研究方向:
- 与m6A甲基化类似,m5C甲基化已被证明与肿瘤、神经系统紊乱、代谢性疾病、病毒感染以及个体发育等密切相关。
- 此外,RNA甲基化(m5C)与人类疾病密切相关,其功能涉及调控干细胞应激、细胞毒性应激、mRNA出核和植物细胞发育及基因表达等方面。
实验策略:
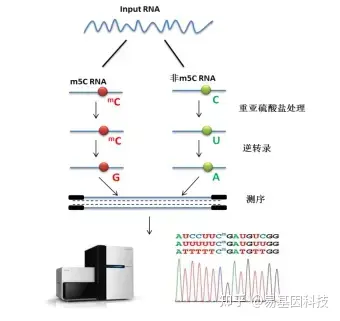
易基因RNA m5C甲基化建库测序示意图
易基因科技提供全面的RNA甲基化研究整体解决方案。
参考文献:
Li M, Tao Z, Zhao Y, Li L, Zheng J, Li Z, Chen X. 5-methylcytosine RNA methyltransferases and their potential roles in cancer. J Transl Med. 2022 May 13;20(1):214.
相关阅读:
科研速递:RNA-BS揭示叶酸调控神经干细胞m5C修饰和mRNA翻译机制
国人佳作:m5C高甲基化介导EGFR突变的非小细胞肺癌耐药潜在机理