双膦酸盐类药物是强效骨吸收抑制剂,是治疗骨质疏松症、多发性骨髓瘤、骨转移等疾病的首选药物。这些药物通过抑制甲羟戊酸通路和促进破骨细胞凋亡来促进骨吸收。双膦酸盐类药物是治疗骨质疏松症和肿瘤相关骨病的标志性药物。然而,在几十年的临床应用中,双膦酸盐类药物已经引起了严重的副作用。
m6A甲基化在骨代谢疾病的发病机制中起着重要作用,未来针对m6A甲基化的分子靶向治疗将补充甚至替代传统药物治疗。那RNA甲基化是否参与双膦酸盐抑制破骨细胞过程呢?
2023年11月13日,上海交通大学医学院附属第九人民医院Jiang Li、Wei Wang,上海交通大学医学院附属同仁医院Wen-jia Wei,和南京医科大学附属口腔医院Ping Zhang团队合作在《Cell Death & Disease volume》杂志发表题为” Exosome-targeted delivery of METTL14 regulates NFATc1 m6A methylation levels to correct osteoclast-induced bone resorption”的研究论文,该研究本研究采用MeRIP-Seq、荧光素酶报告基因检测、meRIP等方法从RNA甲基化角度阐明NFATc1对破骨细胞的调控机制。

标题:Exosome-targeted delivery of METTL14 regulates NFATc1 m6A methylation levels to correct osteoclast-induced bone resorption(外泌体靶向递送METTL14可调节NFATc1 m6A甲基化水平,以纠正破骨细胞诱导的骨吸收)
时间:2023-11-13
期刊:Cell Death Dis
影响因子:IF 9 / 1区
技术平台:MeRIP-seq、RNA-seq、荧光素酶报告基因实验等
研究摘要:
骨质疏松症对公众健康有着深远的影响。一线用药双膦酸盐常引起颌骨坏死,同时抑制破骨细胞。因此,开发有效的治疗方法非常重要。本研究结果表明,以4249A为功能位点的唑来膦酸(zoledronic acid,ZOL)导致的NFATc1 m6A甲基化水平升高与破骨细胞骨吸收能力减少高度相关。METTL14上游通过甲基化功能位点NFATc1调控破骨细胞骨吸收。下游的YTHDF1和YTHDF2在METTL14上调m6A甲基化水平后对NFATc1的转录后调控表现出拮抗作用。本研究采用MeRIP- seq、荧光素酶报告基因实验、MeRIP等方法从RNA甲基化角度阐明NFATc1对破骨细胞的调控机制。此外,外泌体上EphA2过表达是靶向递送METTL14到破骨细胞的有效生物学方法。本研究表明外泌体释放的METTL14可以通过增加NFATc1的m6A甲基化水平来抑制破骨细胞,帮助绝经后骨质疏松患者保留骨量,避免引发颌骨坏死,从而成为治疗骨质疏松的新型生物活性分子。
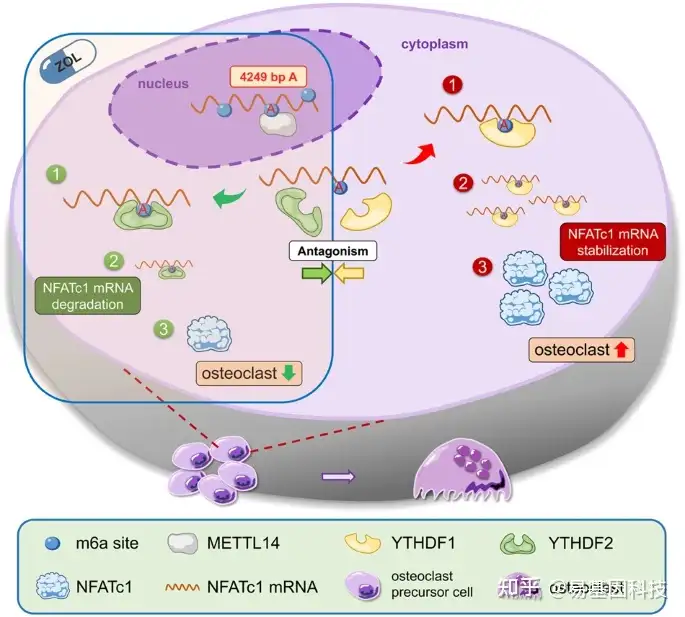
本研究示意图
ZOL导致NFATc1 m6A甲基化水平增加,其中4249bp A为功能位点,与破骨细胞骨吸收功能下降高度相关。上游,METTL14通过甲基化功能位点NFATc1调控破骨细胞骨吸收。下游,YTHDF1和YTHDF2在METTL14上调m6A甲基化水平后对NFATc1的转录后调控表现出拮抗作用。
研究结果
(1)高通量测序和差异表达基因
经RANKL诱导后,在有或没有ZOL (5 μM)刺激下分别收集RAW264.7细胞样本。提取两组样本的总RNA进行RNA-seq和m6A-seq检测。
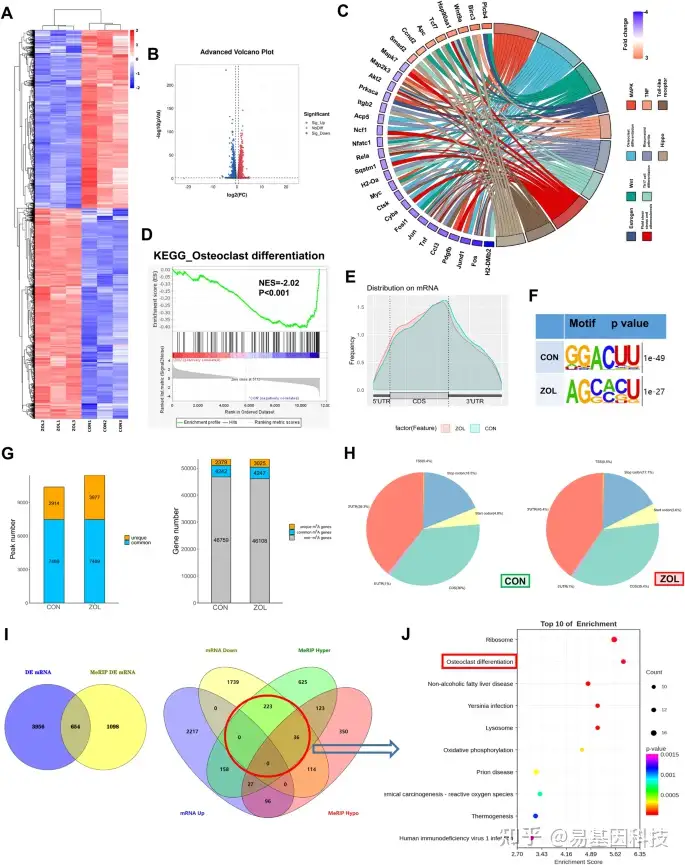
图1:高通量测序和差异表达基因
经RANKL诱导后,在有或没有ZOL (5 μM)刺激下分别收集RAW264.7细胞样本。提取两组样本的总RNA进行RNA-seq和m6A-seq检测。
A-B. 热图和火山图显示CON组和ZOL组差异表达的mRNA。
C. KEGG分析在和弦图中可视化。
D. RNA序列数据的破骨细胞分化过程中的变化基因集富集分析(GSEA)图。
E. 两组mRNA转录组中m6A富集图谱。
F. 两组中主要的共有motif中鉴定出m6A-seq peaks。
G. 在m6A-seq中发现的CON组和ZOL组之间的m6A peaks和m6A修饰基因数量。
H. m6A peak分布图,显示两组中m6A peak占总peaks的比例。
- 维恩图显示两组中654个差异表达和差异m6a甲基化的交集基因(左)。根据mRNA水平和m6A甲基化水平对差异表达基因进行分类(右)。
J. 气泡图显示通过基因交叉分析获得的差异表达基因对感兴趣的生物过程的富集(图1I的红圈)。
(2)ZOL对成骨细胞和破骨细胞的作用
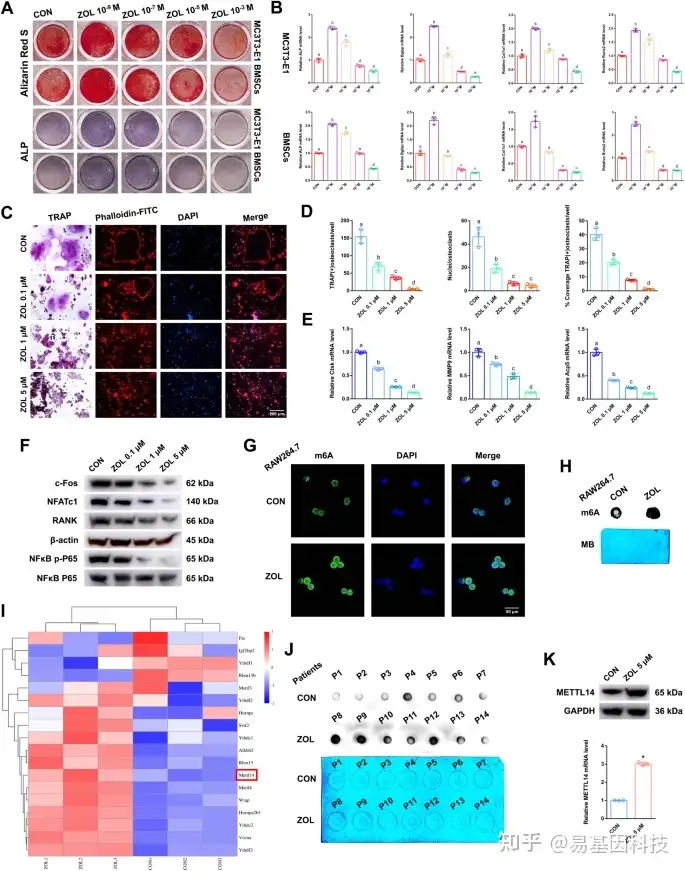
图2:ZOL对成骨细胞和破骨细胞的作用
- 不同浓度的ZOL,成骨诱导21d或7d后对MC3T3-E1细胞和BMSCs进行茜素红S(Alizarin Red S,ARS)或ALP(Alkaline phosphatase)染色。
- 不同浓度ZOL作用下MC3T3-E1细胞和BMSCs中ALP、Bglap、Col1α1和Runx2的相对表达水平。
- TRAP染色和F-actin带染色检测不同浓度ZOL作用下破骨细胞分化和骨吸收能力。比例尺:200 μm。
- 不同浓度ZOL作用下TRAP阳性破骨细胞数量、覆盖率及细胞核的直方图。
- 不同浓度ZOL作用下RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
- western blot检测不同浓度ZOL作用下RAW264.7细胞中c-fos、NFATc1、RANK和NFκB p-P65蛋白的表达水平。
G-H. 免疫荧光图像和m6A斑点印迹实验显示了ZOL刺激后RAW264.7细胞的整体m6A水平。比例尺:50 μm。
- 热图显示ZOL刺激后m6A甲基化相关酶的差异表达。
J. m6A斑点印迹法显示双膦酸盐治疗或未治疗的绝经后妇女的整体m6A水平。
K. ZOL刺激后,分别采用RT-qPCR和western blot检测RAW264.7细胞中METTL14的mRNA和蛋白表达水平。数据代表三个生物重复,用平均值±SD表示(*p < 0.05)。不同字母(a、b、c、d、e)组间差异显著(p < 0.05)。
(3)ZOL或METTL14抑制破骨细胞分化,并增加破骨细胞前体细胞的m6A甲基化水平
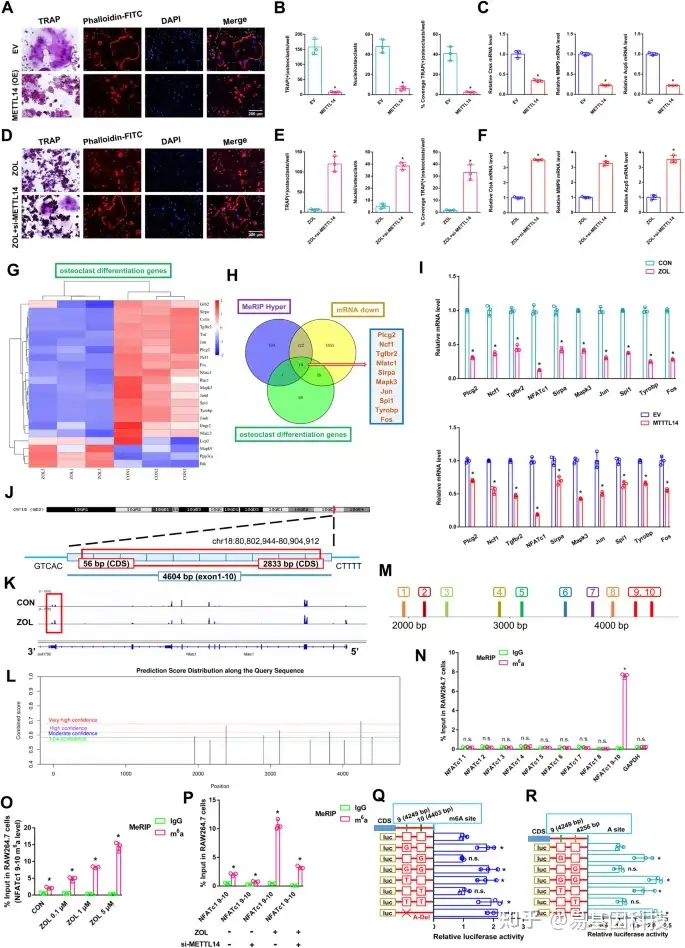
图3:NFATc1–9片段对METT14调节破骨细胞分化过程的作用。
首先,将METTL14转染至RAW264.7细胞并制备用于进一步研究。
- TRAP染色和F-actin带染色检测两组破骨细胞分化情况。比例尺:200 μm。
- 两组TRAP阳性破骨细胞数量、覆盖率、细胞核直方图。
- 两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
ZOL刺激后,将si-METTL14转染到RAW264.7细胞,制备用于进一步研究。 - TRAP染色和F-actin带染色检测两组破骨细胞分化情况。比例尺:200 μm。
- 两组trap阳性破骨细胞数量、覆盖率、细胞核直方图。
- 两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
- ZOL刺激后破骨细胞分化差异表达基因的热图。
- KEGG分析揭示了三个交集的差异表达基因:破骨细胞分化基因,MeRIP高表达基因和mRNA下调基因。
- RT-qPCR分析显示ZOL刺激或METTL14过表达后10个差异表达基因的表达水平。
- NFATc1的基因组位点示意图。
- 在ZOL刺激或未刺激下,NFATc1转录本中meRIP-Seq的m6A peaks可视化。m6A peaks位于NFATc1的3‘UTR区。
- SRAMP网站上NFATc1潜在的m6A甲基化位点。
- 根据潜在的m6A甲基化位点将NFATc1分为9个片段。
- m6A-RT-qPCR检测ZOL刺激后抗m6A组和抗IgG组之间NFATc1的9个片段富集情况。
- m6A-RT-qPCR检测NFATc1–9、10片段随着ZOL浓度的增加而富集。
- m6A-RT-qPCR检测ZOL或si-METTL14刺激下NFATc1–9、10片段的富集情况。
Q-R. 通过荧光素酶报告基因的逐步突变验证两个m6A修饰位点。数据代表三个生物重复,用平均值±SD表示(*p < 0.05)。
(4)NFATc1基因参与METT14抑制破骨细胞分化过程,只有NFATc1 - 9片段表现出高水平m6A甲基化
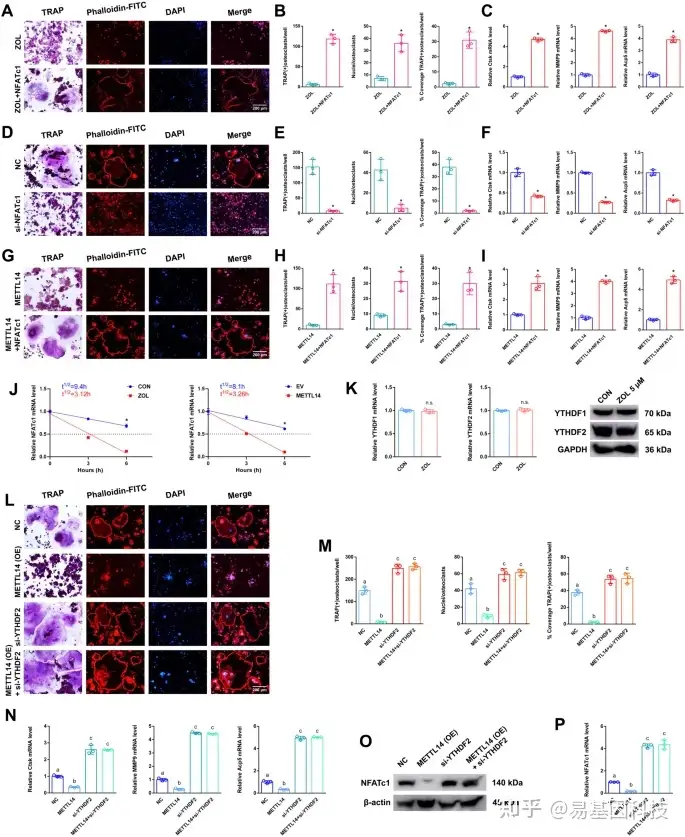
图4:METTL14对NFATc1转录后调控作用
ZOL刺激后,将NFATc1转染至RAW264.7细胞并制备用于进一步研究。
- TRAP染色和F-actin带染色检测两组破骨细胞分化情况;比例尺:200 μm。
- 两组TRAP阳性破骨细胞数量、覆盖率、细胞核直方图。
- 两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。将si-NFATc1转染RAW264.7细胞,制备用于进一步研究。
- TRAP染色和F-actin带染色检测两组破骨细胞分化情况。比例尺:200 μm。
- 两组TRAP阳性破骨细胞数量、覆盖率、细胞核直方图。
- 两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
将NFATc1或METTL14按不同分组分别或同时转染RAW264.7细胞,制备用于进一步研究。 - TRAP染色和F-actin带染色检测两组破骨细胞分化情况。比例尺:200 μm。
- 两组TRAP阳性破骨细胞数量、覆盖率、细胞核直方图。
- 两组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
- 在ZOL或METTL14刺激下,根据线性回归分析预测NFATc1 mRNA半衰期。
- ZOL刺激RAW264.7细胞后,分别采用RT-qPCR和western blot检测YTHDF1和YTHDF2的mRNA和蛋白表达水平。
将si-YTHDF2或METTL14按不同分组分别或同时转染RAW264.7细胞,制备用于进一步研究。 - TRAP染色和F-actin带染色检测4组破骨细胞分化情况。比例尺:200 μm。
- 4组TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
- 4组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
O-P. 采用RT-qPCR和western blotting检测4组RAW264.7细胞中NFATc1的mRNA和蛋白表达水平。
数据代表三个生物学重复,用平均值±SD表示(*p < 0.05)。不同字母(a、b、c、d、e)组间差异显著 (p < 0.05)。
(5)YTHDF2通过METTL14上调NFATc1的甲基化水平,从而对NFATc1的转录后调控表现出负相关
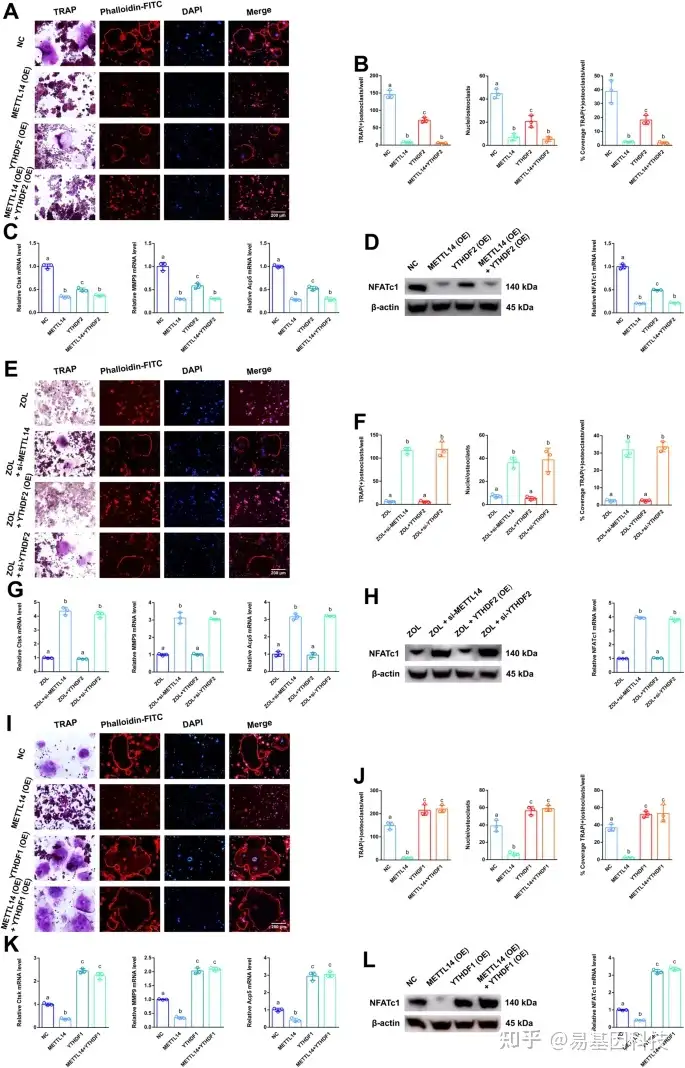
图5:YTHDF1和YTHDF2对NFATc1转录后调控作用。
将YTHDF2或METTL14按不同分组分别或同时转染RAW264.7细胞,并制备用于进一步研究。
- TRAP染色和F-actin带染色检测4组破骨细胞分化情况。比例尺:200 μm。
- 4组TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
- 4组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
- 分别采用RT-qPCR和western blot分析4组RAW264.7细胞中NFATc1的mRNA和蛋白表达水平。
ZOL刺激RAW264.7细胞后,根据不同分组分别转染YTHDF2、si-YTHDF2或si-METTL14,并制备用于进一步研究。 - TRAP染色和F-actin带染色检测4组破骨细胞分化情况;比例尺:200 μm。
- 4组TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
- 4组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
- 分别采用RT-qPCR和western blot分析4组RAW264.7细胞中NFATc1的mRNA和蛋白表达水平。
将YTHDF1或METTL14按不同分组分别或同时转染RAW264.7细胞,并制备用于进一步研究。 - TRAP染色和F-actin带染色检测4组破骨细胞分化情况;比例尺:200 μm。
- 4组TRAP阳性破骨细胞数量、覆盖率及细胞核直方图。
- 4组RAW264.7细胞中Ctsk、MMP9和Acp5的相对表达水平。
- 分别采用RT-qPCR和western blot分析4组RAW264.7细胞中NFATc1的mRNA和蛋白表达水平。
数据代表三个生物重复,用平均值±SD表示。不同字母(a和b)表示多个组之间的显著差异(p < 0.05)。
(6)YTHDF1和YTHDF2在上调METTL14甲基化水平后对NFATc1转录后调控表现出拮抗作用
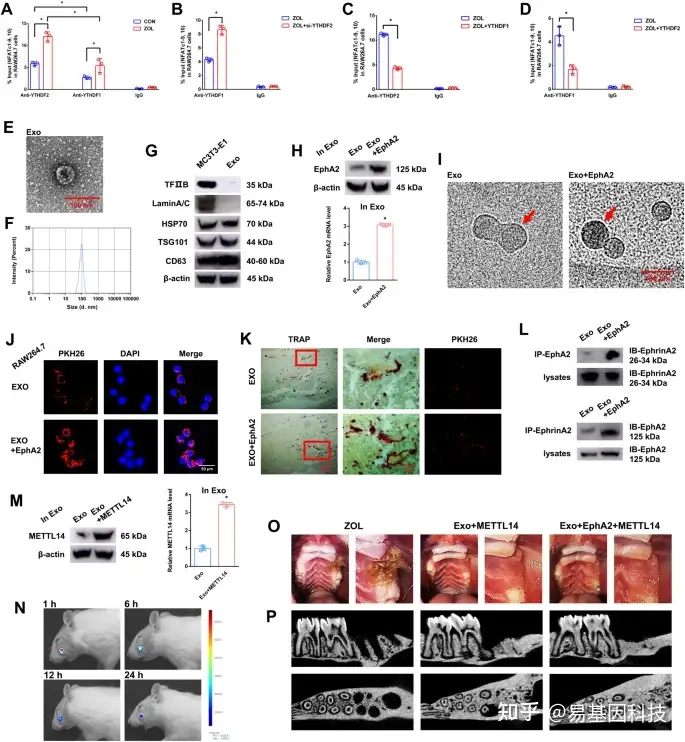
图6:EphA2-EphrinA2对接受外泌体的破骨细胞的影响。
A-D.RIP实验检测不同条件下NFATc1–9、10片段的富集率。
E. 外泌体的电子显微图像。比例尺:100 nm。
F. MC3T3-1细胞分泌的外泌体大小分布。
G. western blot检测MC3T3-E1细胞裂解物或外泌体中TFIIB、Lamin A/C、HSP70、TSG101和CD63的蛋白水平。
H. 将EphA2转染至ME3T3-E1细胞后,分别采用RT-qPCR和western blot检测外泌体中EphA2的mRNA和蛋白表达水平。
- 外泌体的冷冻透射电子显微镜图像。红色箭头表示纳米金探针(1.4 nm)与EphA2受体结合。比例尺:100 nm。
J. MC3T3-E1细胞外泌体进入RAW264.7细胞的免疫荧光图像。用PKH26标记外泌体,并在有或没有EphA2情况下过表达。比例尺:50 nm。
K. 荧光显微镜和TRAP染色分析显示注射到骨髓pkh26标记的外泌体。红框表示外泌体被破骨细胞吸收。比例尺:200 μm、50 μm。
L. 免疫共沉淀(co-IP)分析表明EphA2-EphrinA2和EphrinA2-EphA2的结合作用。
M. METTL14转染ME3T3-E1细胞后,分别采用RT-qPCR和western blot检测外泌体中METTL14的mRNA和蛋白表达水平。
N. 大鼠活体成像分析显示,Cy5.5标记的外泌体特异性定位于左上颌第一磨牙拔除后的窝内。
O. 拔牙8周后,大鼠双膦酸盐相关性颌骨坏死(BRONJ)及两种外泌体处理组(Exo+METTL14和Exo+EphA2 +METTL14)的代表性图片。
P. 注射ZOL或外泌体8周后,采用micro-CT观察各组大鼠骨组织形态学变化。
数据代表三个生物学重复,用平均值±SD表示(*p < 0.05)。
(7)外泌体中的METTL14对体内骨丢失具有明显的挽救作用
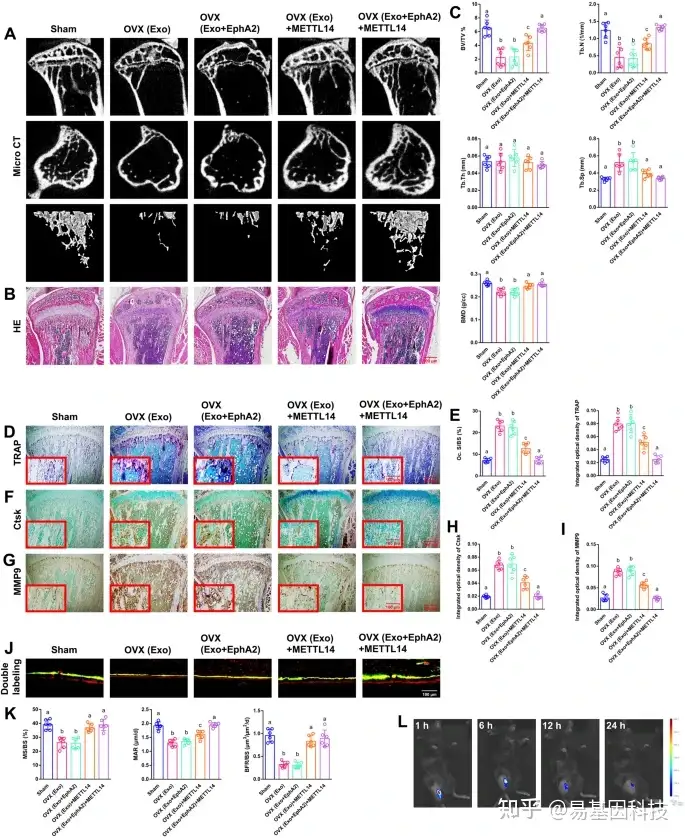
图7:METTL14在体内的作用
将EphA2或METTL14转染至MC3T3-E1细胞中,并按照不同的组分别或同时从细胞上清液外泌体中收集。
A-B. 外泌体注射8周后,采用micro-CT和H&E染色检测骨组织形态学参数。比例尺:500 nm。
C. BV/TV、Tb.N、Tb.Th、Tb.Sp和BMD 五组的直方图。
D. TRAP染色评估破骨细胞分化和骨吸收能力。比例尺:200 μm、100 μm。
E. 破骨细胞Oc直方图。TRAP S/BS及积分光密度值在各组间差异显著。
F-G. 采用Ctsk和MMP9免疫组织化学染色评估破骨细胞分化和骨吸收能力。比例尺:200 μm、100 μm。
H-I. 5组间Ctsk、MMP9积分光密度直方图。
J-K. 基于MS/BS, MAR和BFR/BS的骨皮质动态组织形态学测量的代表性图像。比例尺:100 μm。
L. 小鼠体内成像分析显示,Cy5.5标记的外泌体特异性定位于胫骨骨髓。
数据代表6个生物学重复,用平均值±SD表示。不同字母(a、b、c)组间差异显著(p < 0.05)。
研究小结:
本研究发现NFATc1基因m6A甲基化水平与破骨细胞诱导的骨吸收之间存在强相关性。4249 A是NFATc1基因的m6A甲基化功能位点。在先前的研究也报告了类似的结论。m6A修饰导致mRNA和lncRNA的局部结构发生变化,从而促进了异质核不均一核糖核蛋白C (hnRNP C)的结合。2577个m6A残基特异性地破坏了lncRNA MALAT1的发夹柄(hairpin-stem)稳定性,从而增加对向U-tract的可及性或单链性,并改善了与hnRNP C的互作。通过m6A依赖性RNA结构重塑来调控RNA-蛋白质互作机制被称为“m6A开关(m6A switch)”。m6A功能位点是相关生物学效应的核心。这个位于NFATc1 4249 A的“m6A开关”与破骨细胞分化和骨吸收密切相关。METTL14、YTHDF1或YTHDF2在不同程度上调控“m6A开关”节点。两个研究结果表明,与m6A甲基化相关的破骨细胞骨吸收由同一信号通路(NFκB)中不同的关键分子(上游RANK和下游NFATc1)共同调控。这一发现证明了m6A甲基化在破骨细胞分化过程中起着关键作用,并且每个关键分子的基因上都有m6A甲基化功能位点。这一理论基础为通过m6A甲基化功能位点精确控制破骨细胞分化治疗骨质疏松症提供了新的思路。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
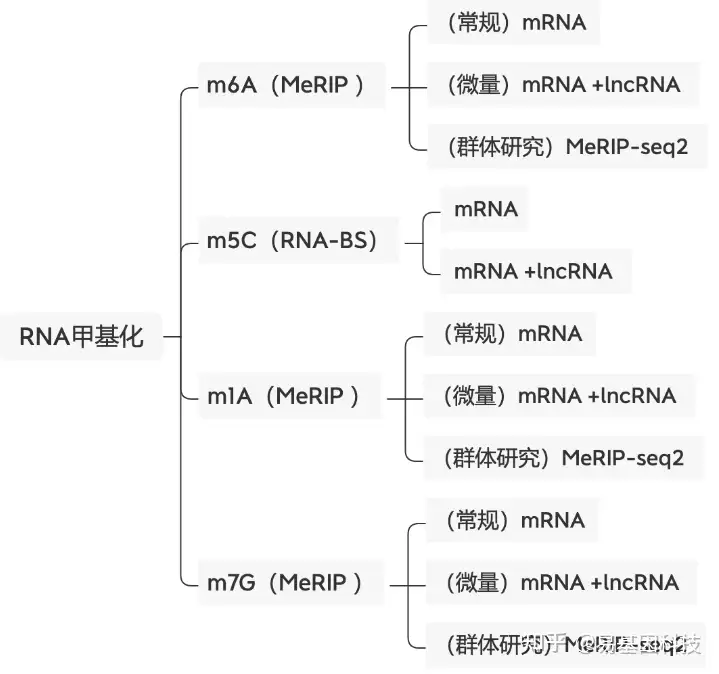
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
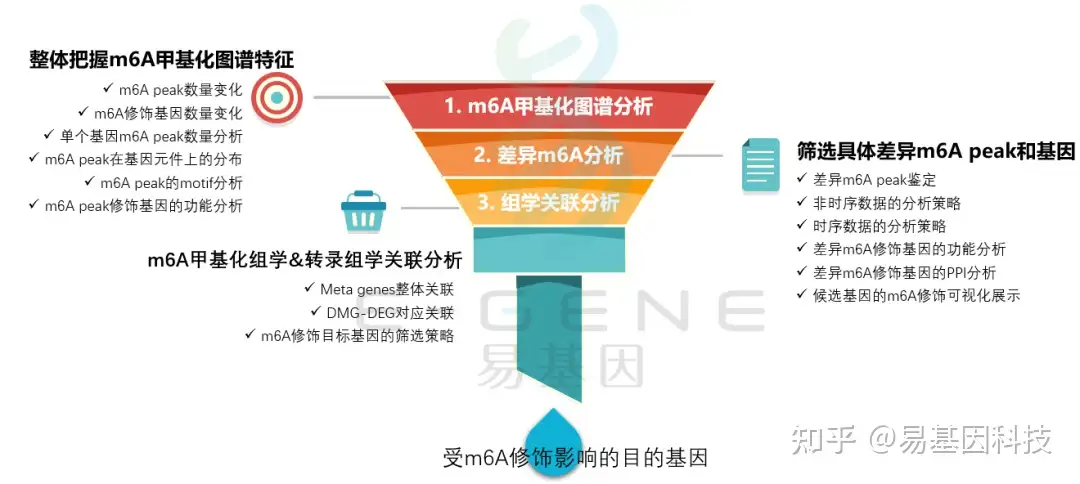
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
易基因提供全面的RNA甲基化研究解决方案,详询易基因:0755-28317900.
参考文献:
Yang JG, Sun B, Wang Z, Li X, Gao JH, Qian JJ, Li J, Wei WJ, Zhang P, Wang W. Exosome-targeted delivery of METTL14 regulates NFATc1 m6A methylation levels to correct osteoclast-induced bone resorption. Cell Death Dis. 2023 Nov 13;14(11):738. pii: 10.1038/s41419-023-06263-4. doi: 10.1038/s41419-023-06263-4. PubMed PMID: 37957146.
相关文献:
MeRIP-seq+ChIP-seq等揭示m6A甲基化在休眠期转录休眠调控中的潜在功能 | 发育研究
植物抗逆:MeRIP-seq等揭示mRNA m⁶A甲基化调控拟南芥的抗寒性分子机制