大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
植物通过改变数千个基因的mRNA丰度以促进其生理和代谢过程,从而对低温应激进行响应。在转录后水平上,这些冷应激应答转录本经历可变剪接、microRNA介导的调控和可变多腺苷酸化等。最近研究表明,m6A、m5C等RNA修饰可以影响RNA调控和鉴定mRNA修饰稳定性,从而揭示了另一层在调控基因表达中发挥重要作用的转录后调控。m6A在植物生长发育中的重要性已经得到了重视,但m6A在胁迫条件下的重要性仍未得到充分探讨,因此m6A修饰在冷胁迫条件下的应激机制研究具有非常重要意义。
2022年8月,美国俄克拉荷马州立大学Ramanjulu Sunkar团队和宾夕法尼亚大学Brian D. Gregory团队合作以“mRNA N6-methyladenosine is critical for cold tolerance in Arabidopsis”为题在《the plant journal》杂志发表研究论文,该研究以拟南芥为对象,通过甲基化RNA免疫沉淀测序(MeRIP-seq)揭示了表观转录组(m6A甲基化)在拟南芥抗寒性中的关键作用。

标题:mRNA N6-methyladenosine is critical for cold tolerance in Arabidopsis(mRNA N6-甲基腺苷对拟南芥的抗寒性至关重要)
时间:2022-08
期刊:the plant journal
影响因子:IF 7.2
技术平台:m6A-seq(MeRIP-seq)、polysomal-seq(翻译组)、qRT-PCR、Dot-blot等
研究摘要:
本研究为了检测m6A修饰在冷胁迫应激响应中的作用,对冷胁迫(chilling stress)(4°C)24小时的拟南芥幼苗中进行了甲基化RNA免疫沉淀测序(MeRIP-seq),在转录组范围进行m6A甲基化分析,分析揭示了m6A修饰在低温胁迫下的大范围变化。由于已知m6A会影响转录本的稳定性/降解和翻译,本研究分析了这些可能性,分析结果表明在冷胁迫下,冷富集m6A转录本在冷胁迫下表现出mRNA丰度的最大增加,同时核糖体(ribosome)率增加。利用m6A甲基转移酶主要基因突变的mta突变体进一步评估m6A表观转录组对植物抗寒性的意义。与野生型相比,随着CBF和COR基因表达水平的差异,mta突变体对冷处理表现出超敏反应,这由根的初生生长、生物量和活性氧积累决定。此外,非驯化和冷驯化的mta突变体都表现出对抗冷冻的超敏反应。总之,本研究表明了表观转录组在拟南芥抗寒性中的关键作用。
研究结果
(1)MeRIP-seq鉴定在冷胁迫下m6A富集或m6A缺失的转录本
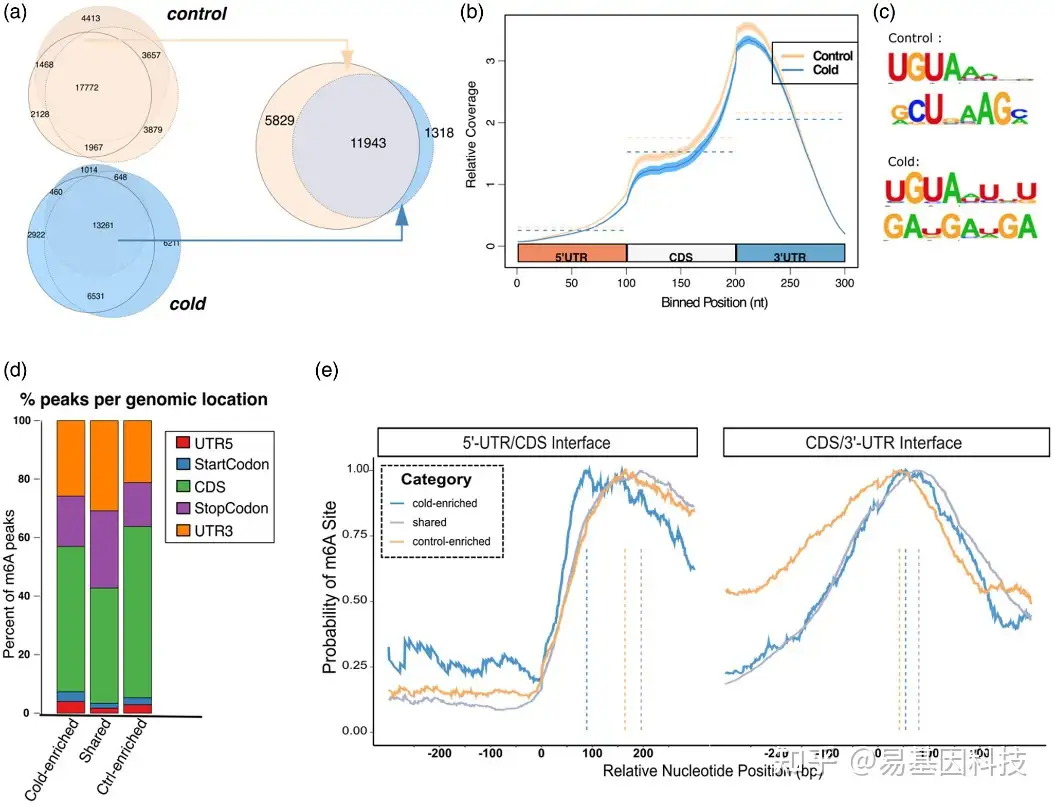
图1:拟南芥m6A表现出3′UTR位点偏倚,对冷胁迫无响应的peaks偏倚更强。
(a) 冷处理样品和对照处理样品的生物学重复进行重叠获得的高置信度m6A peaks分析鉴定出5829个对照富集(冷缺失)peaks、1318个冷富集m6A peaks和11个 943个共有peaks(未改变)。
(b) MeRIP-seq reads沿分类转录本的分布。
(c) 通过homer鉴定的RNA motif在目标m6A peaks区域中富集。
(d) 与5′UTR、起始密码子、CDS、终止密码子和3′UTR重叠的冷富集、对照富集和共有m6A peaks的百分比分布。
(e) 转录本的冷富集、对照富集和共有m6A peaks起始和终止密码子周围区域甲基化的核苷酸水平。每个组都被标准化为其在该区域中的最大值
(2)冷应激诱导大范围转录组变化
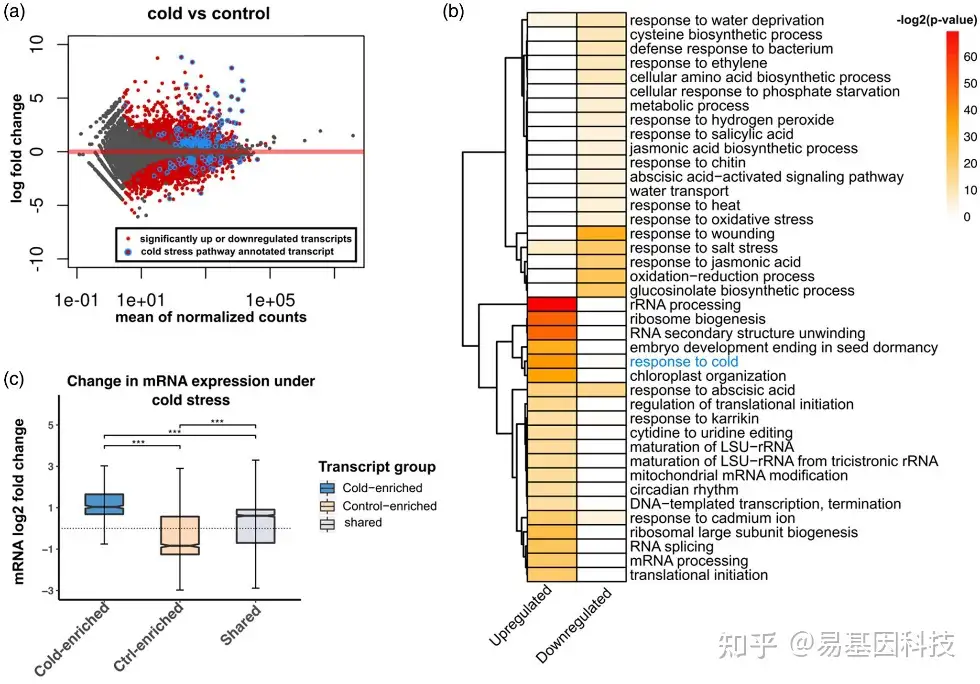
图2:低温胁迫24小时后的转录组学分析结果表明,已知的主要冷响应基因的mRNA丰度增加。
(a)与对照Col-0植株相比,低温处理植株的整体冷诱导的转录组变化MA图。红点代表RNA丰度变化有统计学意义的转录本(调整P<0.05),灰色表示没有变化的转录本。蓝点突出显示已知与植物冷胁迫响应相关的转录本。
(b)在冷胁迫期间显著增加或减少的转录本相关的GO分析热图
(c) 冷处理和对照条件下mRNA丰度的倍数变化与转录本的冷处理和对照组中富集m6A peaks的差异及共有分析
(3)冷富集m6A peaks的转录本表现出多聚体结合增加
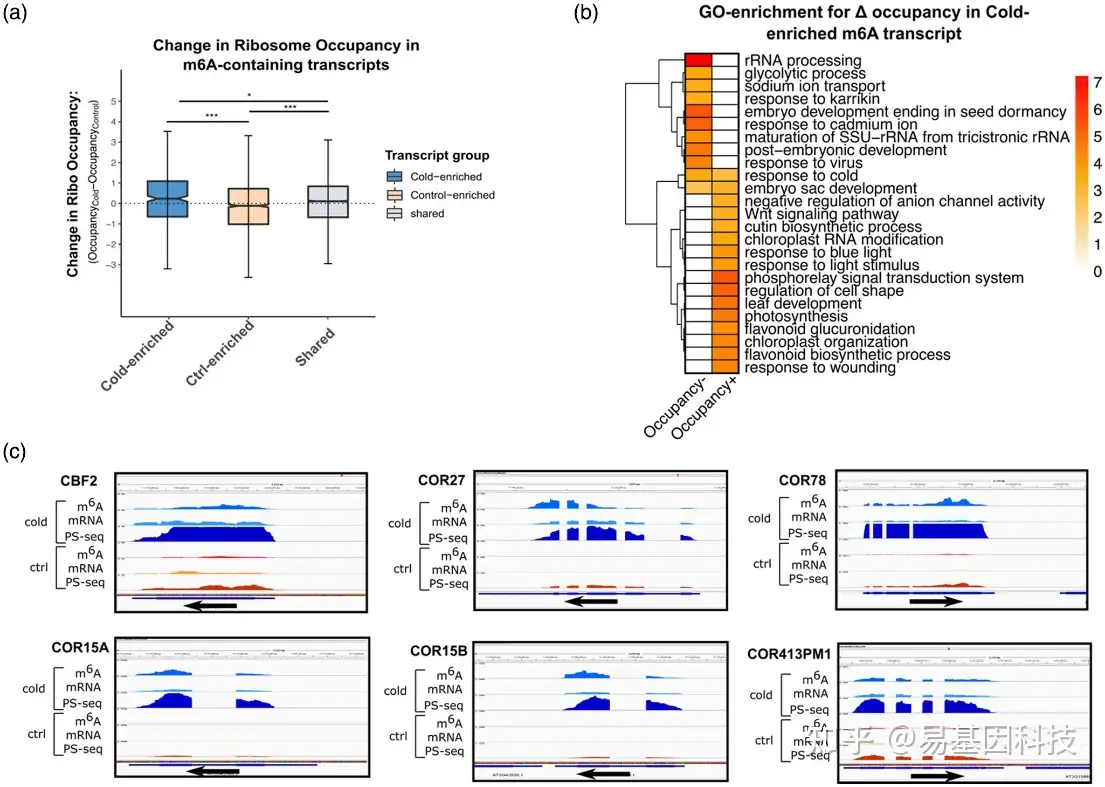
图3:冷富集m6A转录本的peaks对冷处理表现出更高的mRNA丰度和核糖体占有率。
(a) 对照处理和冷处理之间转录本的核糖体占有差异,比较只冷处理和只对照中转录组富集m6A peaks之间的差异,以及在两种条件下的共有差异。
(b)对冷富集m6A转录本的peaks GO分析的生物功能分类。
(c) 基因组浏览器视图(Genome browser views)分析比较主要已知冷调控转录本的meRIP-seq(标记为m6A)、mRNA-seq(标为mRNA)和多聚体分析(polysome profiling,标记为Ps-seq)。箭头表示基因转录的方向。
(4)mta突变体植株对冷胁迫表现出超敏反应
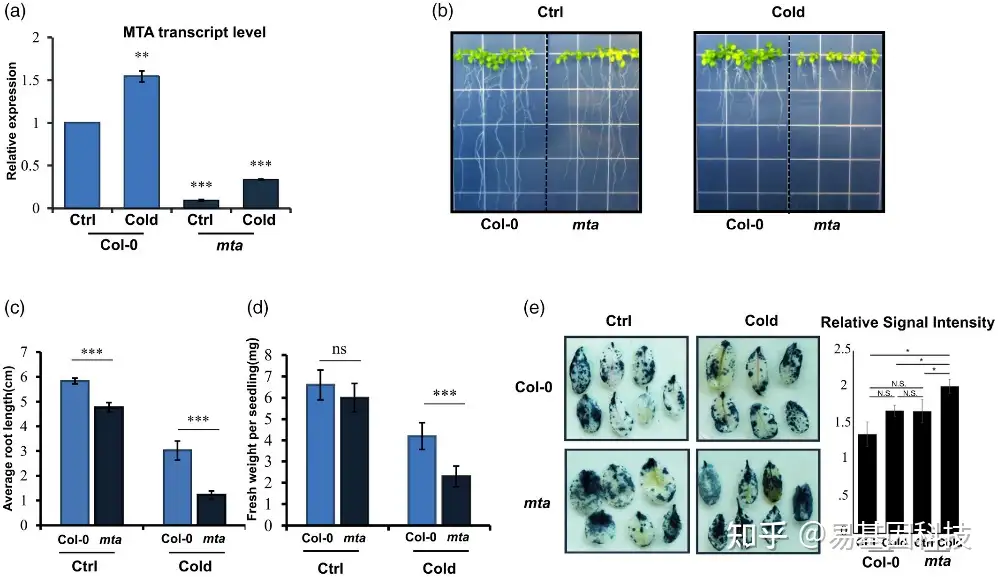
图4:与Col-0植株相比,mta突变体的冷响应揭示了mRNA丰度和多聚体负载差异。
(a)qPCR方法检测与Col-0植物相比,对照和冷条件下MTA突变体中MTA转录本的相对mRNA水平。
(b)与Col-0植株相比,mta突变体的表型检测和冷响应定量分析,
(c)根长(对照幼苗在22°c下生长10 天,而在冷处理下幼苗生长了52天)
(d)鲜重。
(e) 长期低温胁迫后叶片组织中ROS的积累情况。
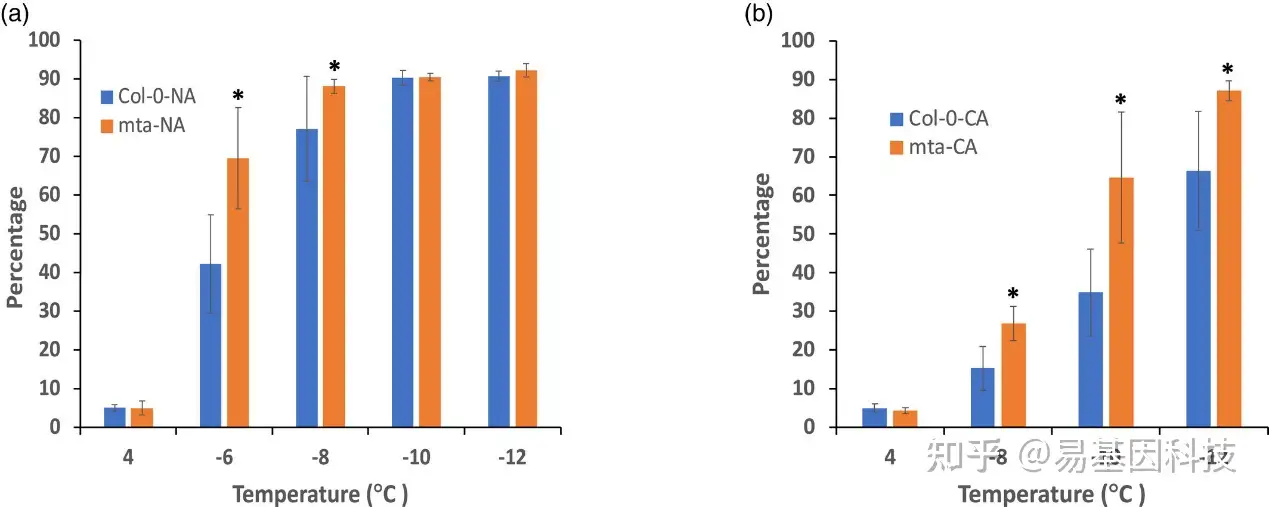
图5:通过电解质渗漏测定法(electrolyte leakage assay)分析mta突变体对冷冻胁迫响应的敏感性。
对5周龄的未驯化(NA)(a)和冷驯化(CA,4°C,7 天)(b)的Col-0和mta突变体植株进行电解质渗漏检测分析。✳表示有统计学意义的差异(P<0.05,t检验)。
(5)冷胁迫下mta突变体的CBF和COR基因表达水平
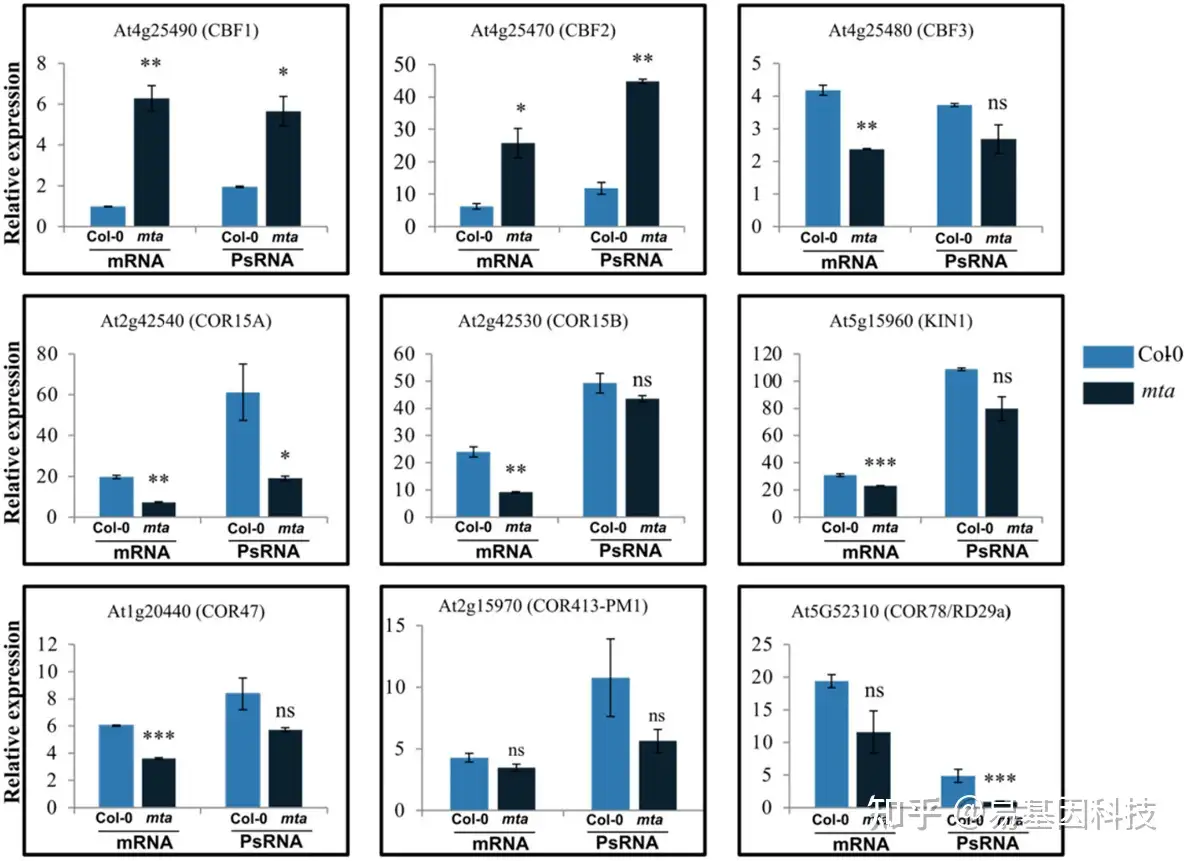
图6:qPCR分析表明,冷富集m6A转录本与RNA丰度以及核糖体占有率之间存在潜在相关性。在Col-0和mta中,候选CBF和COR基因的相对mRNA丰度和多聚体负载的变化通过对照和低温条件下的倍数变化来分析。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
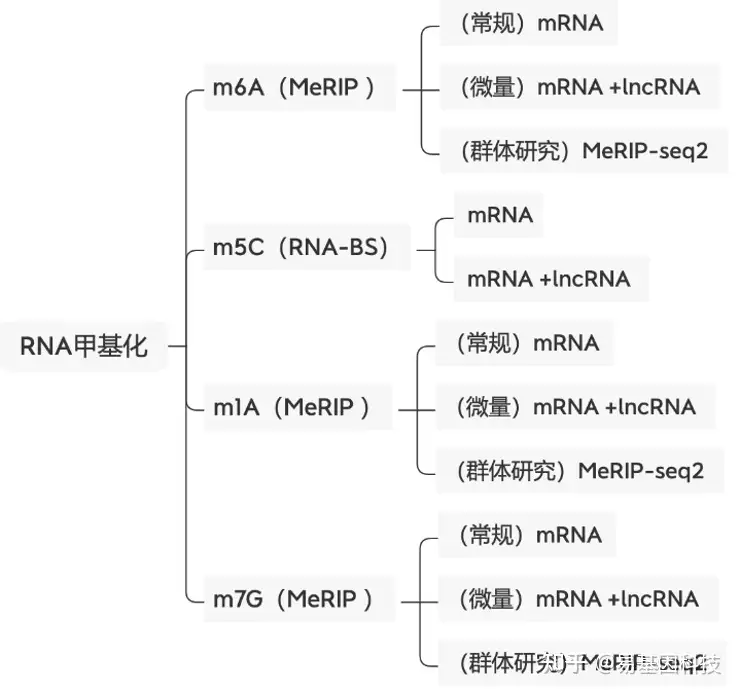
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
易基因科技提供全面的RNA甲基化研究整体解决方案,详询易基因0755-28317900。
参考文献:
Govindan G, Sharma B, Li YF, Armstrong CD, Merum P, Rohila JS, Gregory BD, Sunkar R. mRNA N6 -methyladenosine is critical for cold tolerance in Arabidopsis. Plant J. 2022 Aug;111(4):1052-1068.
相关阅读:
8种表观转录组m⁶A MeRIP-seq的差异甲基化区域(DMR)分析软件比较 | 生信专区