大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
DNA甲基化影响基因组稳定性、转座子沉默和基因表达;它主要发生在对称CG和CHG以及不对称CHH (H = A, C或T)中的胞嘧啶上。RNA介导的DNA甲基化(RNA-directed DNA methylation,RdDM)通路调控植物中所有三种序列背景下的novo DNA甲基化。RdDM通路非常复杂,由许多蛋白质和非编码RNA组成。尽管RdDM是一种重要的表观遗传修饰通路,但其生物学作用和进化重要性仅局限于少数植物物种。在RdDM机制中,小基因家族DNA甲基化因子(FDM) 1-5及其参与De Novo 2 (IDN2)/RDM 12的同源物是重要的组成部分。
草莓是世界各地种植的一种受欢迎水果作物。栽培草莓属于八倍体物种Fragaria X ananassa。二倍体林地草莓Fragaria vesca(F. vesca)是栽培草莓的祖先种,是经常被用作基础研究的模式物种。在栽培草莓果实成熟过程中,由于RdDM活性降低,检测到整体DNA甲基化减少。然而,关于DNA甲基化对草莓其他性状的调控作用知之甚少。
2022年10月6日,华中农业大学园艺学院康春英教授团队以“Factor of DNA methylation 1 affects woodland strawberry plant stature and organ size via DNA methylation”为题在《Plant Physiology》杂志发表研究论文。该研究以林地草莓 (F. vesca)为对象,通过全基因组重亚硫酸盐测序(WGBS)的表观基因组和对应的转录组分析,揭示了DNA甲基化因子1(FDM1)通过调控CHH中的DNA甲基化,在启动子和3’-末端位点具有更强作用,并影响不同组织中的基因表达,改变DNA甲基化水平,从而影响林地草莓的植株高度和果实大小,表明了RdDM在草莓生长发育的关键调控作用。

标题:Factor of DNA methylation 1 affects woodland strawberry plant stature and organ size via DNA methylation (DNA甲基化因子1通过DNA甲基化影响林地草莓植株的生长和果实大小)
时间:2022-10-06
期刊:Plant Physiology
影响因子:IF 7.4 / 1区
技术平台:WGBS、RNA-seq、qRT-PCR分析等
研究摘要:
RNA介导的DNA甲基化(RdDM)是一种表观遗传学过程,RdDM将沉默导向特定的基因组区域和位点。RdDM生物学功能在园艺植物中没有得到深入研究。本研究在林地草莓(Fragaria vesca)分离了EMS(ethyl methane-sulfonate)诱导的(reduced organ size,ros)突变体,与野生型(WT)相比,ros突变体由于细胞数量减少,会产生小的叶片、花朵和果实。候选突变导致FvH4_6g28780中的过早终止密码子,该密码子与编码RdDM通路成分的拟南芥(Arabidopsis thaliana)DNA甲基化因子1(FDM1)具有高度相似性,被命名为FveFDM1。同样,CRISPR/Cas9产生的fvefdm1CR突变体也产生较小的果实。在拟南芥fdm1-1fdm2-1双突变体中过表达FveFDM1回复了RdDM靶位点的DNA甲基化。FveFDM1与De Novo 2(FveIDN2)中参与的同源物在蛋白质复合体中发挥作用。
全基因组重亚硫酸盐测序(WGBS)显示,fvefdm1的全基因组DNA甲基化显著减少,尤其在CHH中。与野生型(WT)组织相比,fvefdm1突变体的不同组织中鉴定出共有和特异性差异表达基因,验证了几种赤霉素(GA)生物合成和细胞周期基因的DNA甲基化和表达水平。与WT相比,fvefdm1幼叶中GA和生长素含量显著降低,且经外源GA和生长素处理也不能恢复fvefdml的果实器官大小。此外,GA处理大大诱导了FveFDM1、FveIDN2、核RNA聚合酶D1(FveNRPD1)、结构域重排甲基化酶2(FveDRM2)和细胞周期基因的表达水平。总之,本研究结果表明了FveFDM1通过RdDM介导的园艺作物DNA甲基化在植物生长和发育中的关键作用。
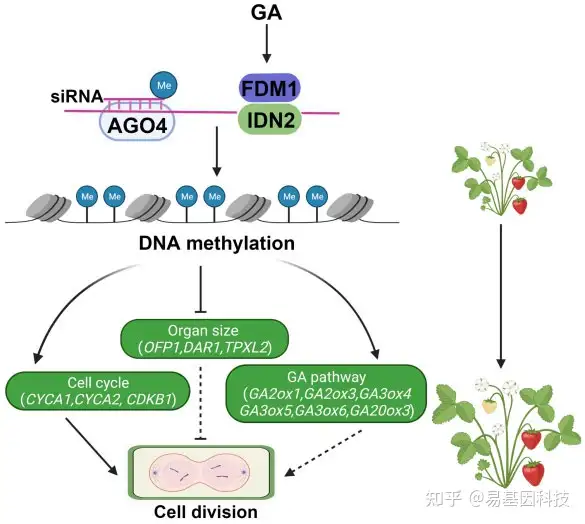
图形摘要:草莓中FveFDM1基因的功能模型
GA诱导FveFDM1和FveIDN2表达,FveFDM1/FveIDN2的蛋白复合体直接结合长RNA,与AGO4-siRNA一起影响靶位点的DNA甲基化水平。一些潜在的下游调控基因被DNA甲基化促进或抑制,通过干扰细胞分裂导致果实器官大小变化。
设计思路

结果图形
(1)F. vesca中的ros突变体在细胞增殖方面存在缺陷
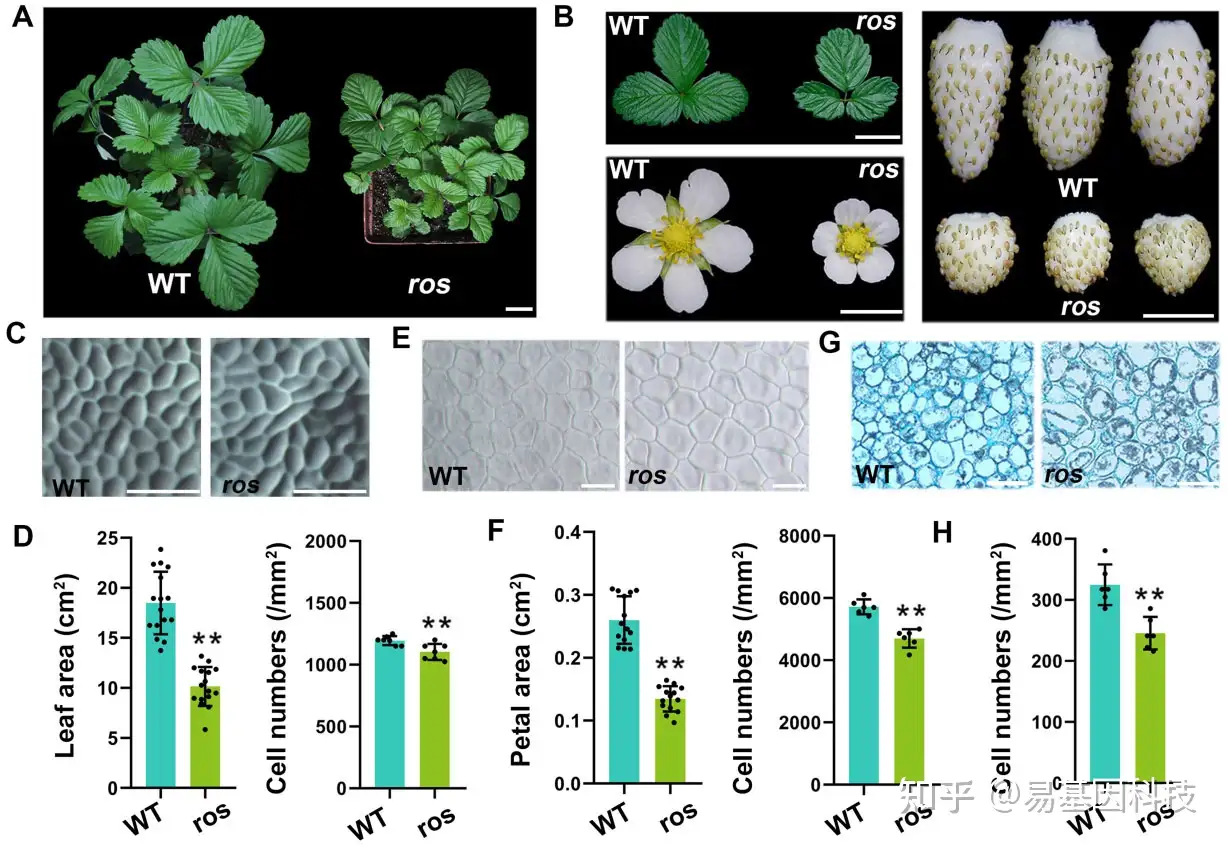
图1:F. vesca 中ros突变体的表型特征。
- WT野生型(F.vesca植株YW)和ros突变体植株。
- WT野生型和ros突变体的叶片、开放的花朵和成熟的果实。在(A)和(B)中,对各个图像的数字提取以比较分析。
- WT和ros的叶片表皮近轴侧图像。
- 叶片表皮的同一区域的细胞数量和叶片面积。
- WT和ros的花瓣表皮的差分干涉对比图像。
- 在花瓣表皮的同一区域的花瓣面积和细胞数量。
- WT和ros果实在髓中心7 DAP时的横截面图像。
- 7 DAP时,果实髓同一区域的细胞数。
在D、F和H中,数据表示为平均值±标准偏差(SD);n=6-15;**P<0.01,学生t检验。比例尺:(A)2cm;(B)1cm;(C和G)100 μm;(E) 10 μm。
(2)ros突变体由FveFDM1中的点突变诱导
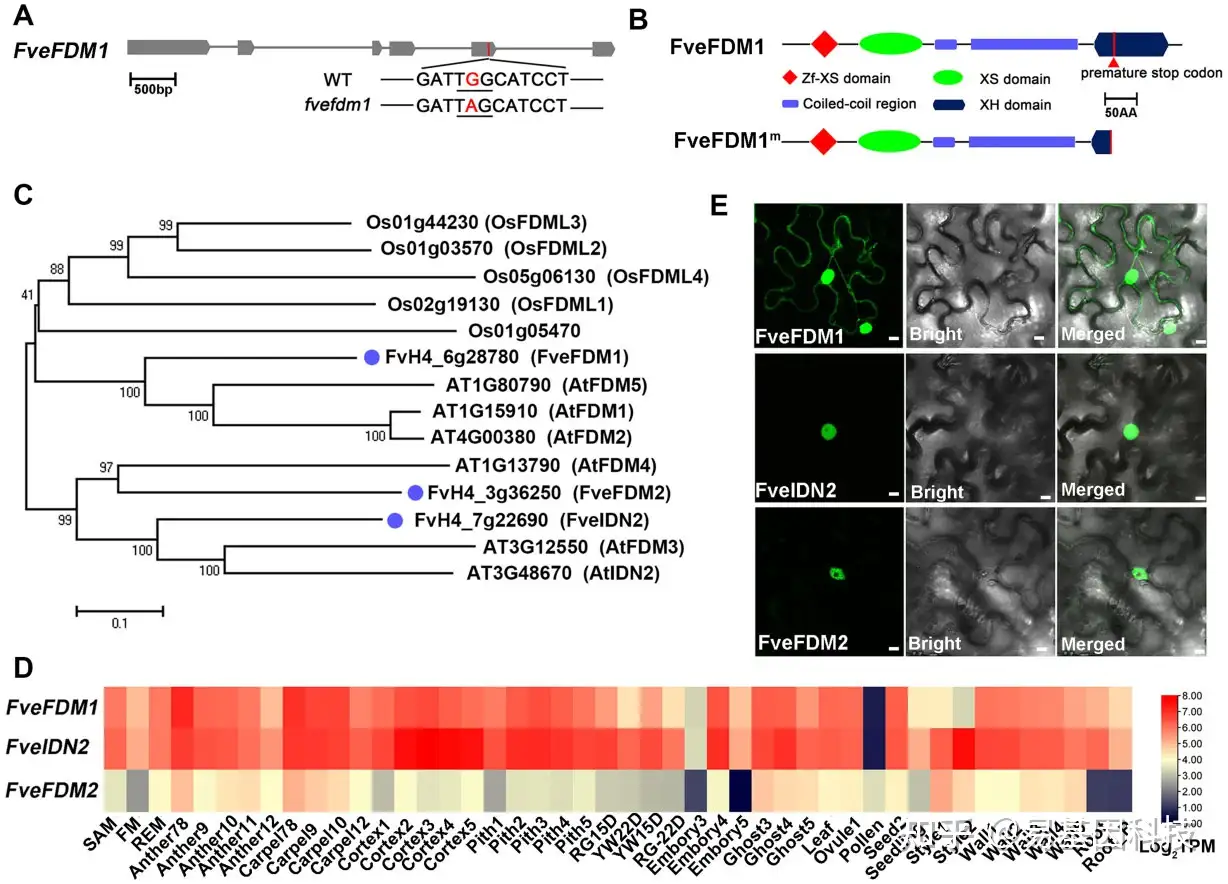
图2:ros致病基因FveFDM1及其同源物特征。
- FveFDM1基因模型和ros致病突变示意图。粗条表示外显子,细条表示内含子。突变密码子有下划线。
- FveFDM1的保守结构域和突变位点示意图。
- FveFDM1及其同源物在草莓、拟南芥和水稻中的系统发育树。Bootstrap值来自1000个重复百分比。蓝点表示草莓基因。每个位点比例尺。
- 基于RNA-seq reads的log2转化转录本,每M reads显示FveFDM1及其同源物在F.vesca不同组织中的表达水平热图。SAM,茎尖分生组织;FM,花分生组织;REM,花托分生组织;RG,F. vesca变种Ruegen;YW,F.vesca品种YW。
- FveFDM1-GFP、FveIDN2-GFP和FveFDM2-GFP在N. benthamiana叶片中的亚细胞定位。比例尺:10 μm。
(3)CRISPR/Cas9敲除FveFDM1导致果实器官变小
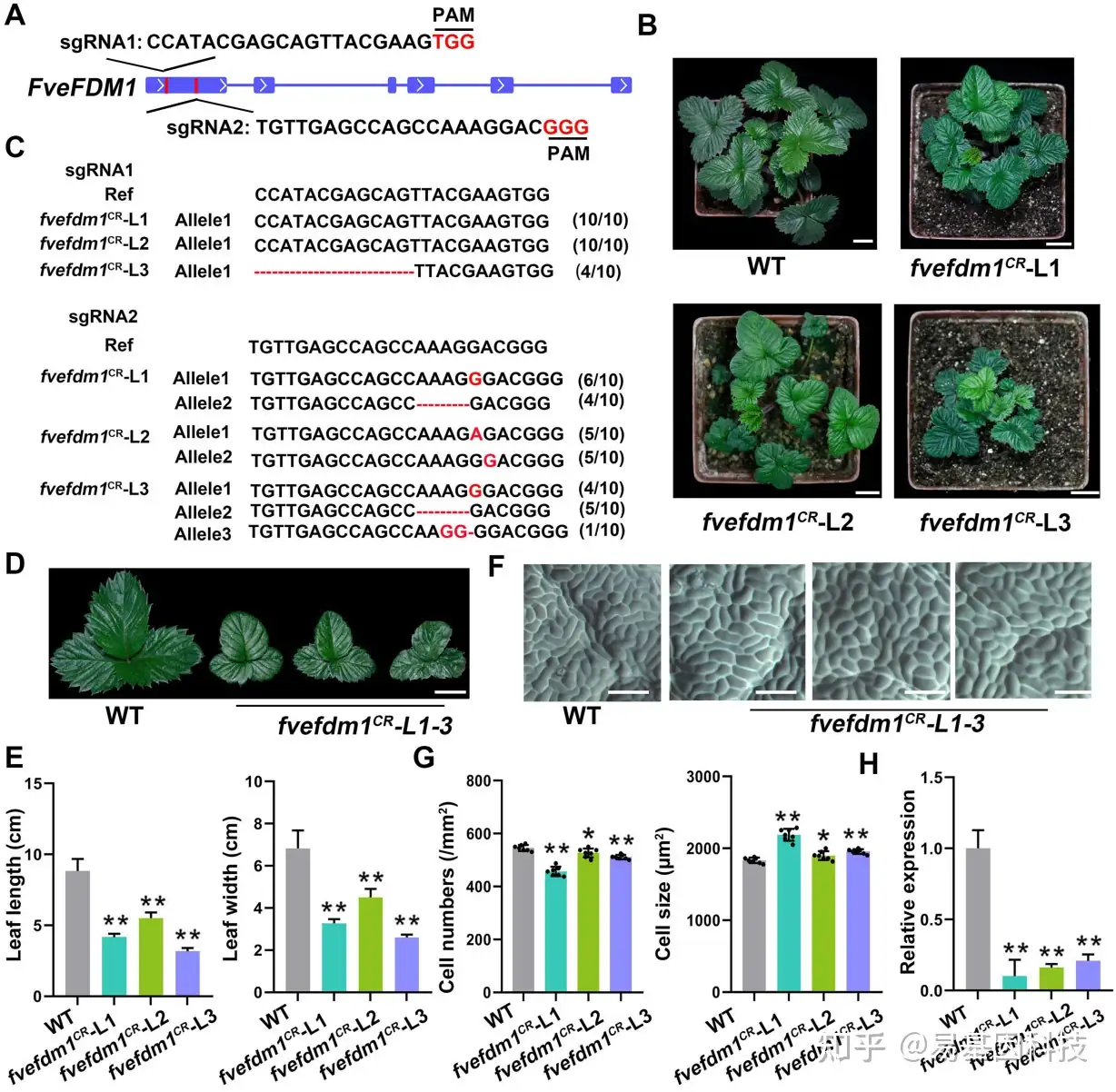
图3:fvefdm1CR突变体的产生和表征。
- FveFDM1中sgRNA靶位点示意图。原间隔区相邻motif(PAM)序列用红色表示。
- T0代中的三个fvefdm1CR突变体(L1-3)和未经编辑的转化植物(WT)。
- 在T0代中fvefdm1CR L1–3的sgRNA靶位点诱导突变。虚线表示敲除的核苷酸。插入的核苷酸用红色表示。所有测序克隆中每个等位基因比例在序列后面表示。
- fvefdm1CR L1–3和WT的成熟叶片。
- fvefdm1CR L1–3和WT的叶片大小。对单个图像进行数字提取以进行比较。
- fvefdm1CR L1–3和WT叶片表皮近轴侧的图像。
- fvefdm1CR L1–3和WT叶片表皮近轴侧的细胞数量和细胞大小。
- FveFDM1在fvefdm1CR L1–3和WT幼叶中的表达水平。
数据为从三个生物学重复中获得的平均值±SD;*P<0.05;**P<0.01,学生t检验。比例尺:(B和D)2 cm;(F)100μm。
(4)FveFDM1在RdDM通路中起作用,并与FveIDN2直接互作
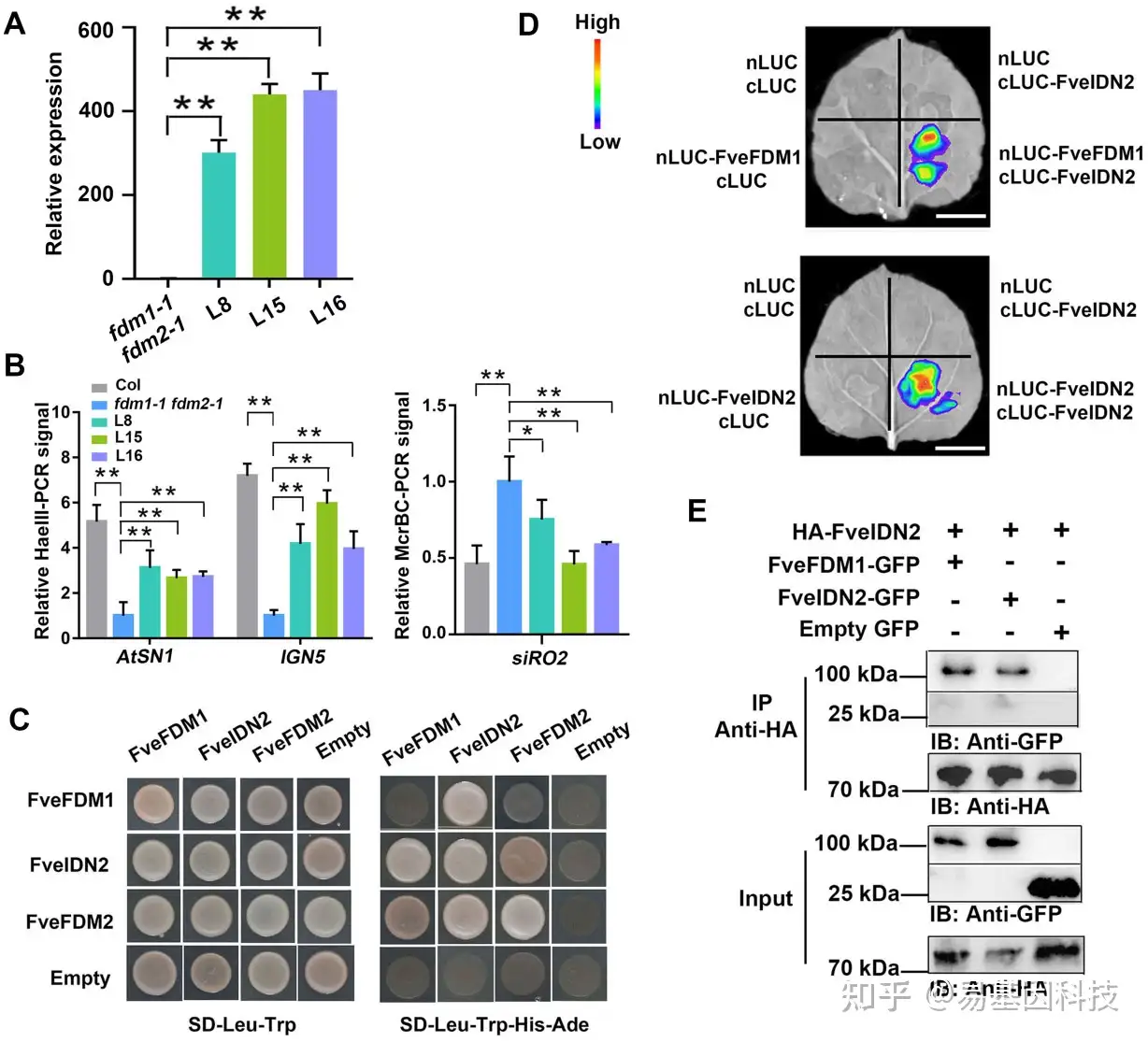
图4:FveFDM1可以回复拟南芥fdm1-1fdm2-1中的DNA甲基化水平,并与FveIDN2直接互作。
- RT–qPCR检测FveFDM1在fdm1-1 fdm2-1和三个FveFDM1-ox转基因系(L8、L15和L16)中的表达水平。
- WT、fdm1-1、fdm2-1和三个转基因系叶片中,通过HaeIII或McrBC和qPCR消化的chop PCR检测三个RdDM靶标AtSN1、IGN5和siR02的DNA甲基化水平。使用未消化的基因组DNA作为每个样品对照扩增。(A)和(B)中的数据从三个生物学重复中获得的平均值±SD;**P<0.01,学生t检验。
- 通过酵母双杂交分析检测FveFDM1、FveIDN2和FveFDM2之间的蛋白质互作。转化的酵母细胞在SD–Leu–Trp或SD–Leu-Trp–His–Ade培养基上生长。AD:激活域;BD:DNA结合域。使用空载体作为对照。
- 利用分裂荧光素酶互补法检测N. benthamiana叶片中FveFDM1和FveIDN2之间的蛋白质互作。比例尺:2 cm.
- Co-IP检测FveFDM1和FveIDN2之间的蛋白质互作。该蛋白在N.benthamiana叶片中瞬时表达。
(5)FveFDM1调控DNA甲基化
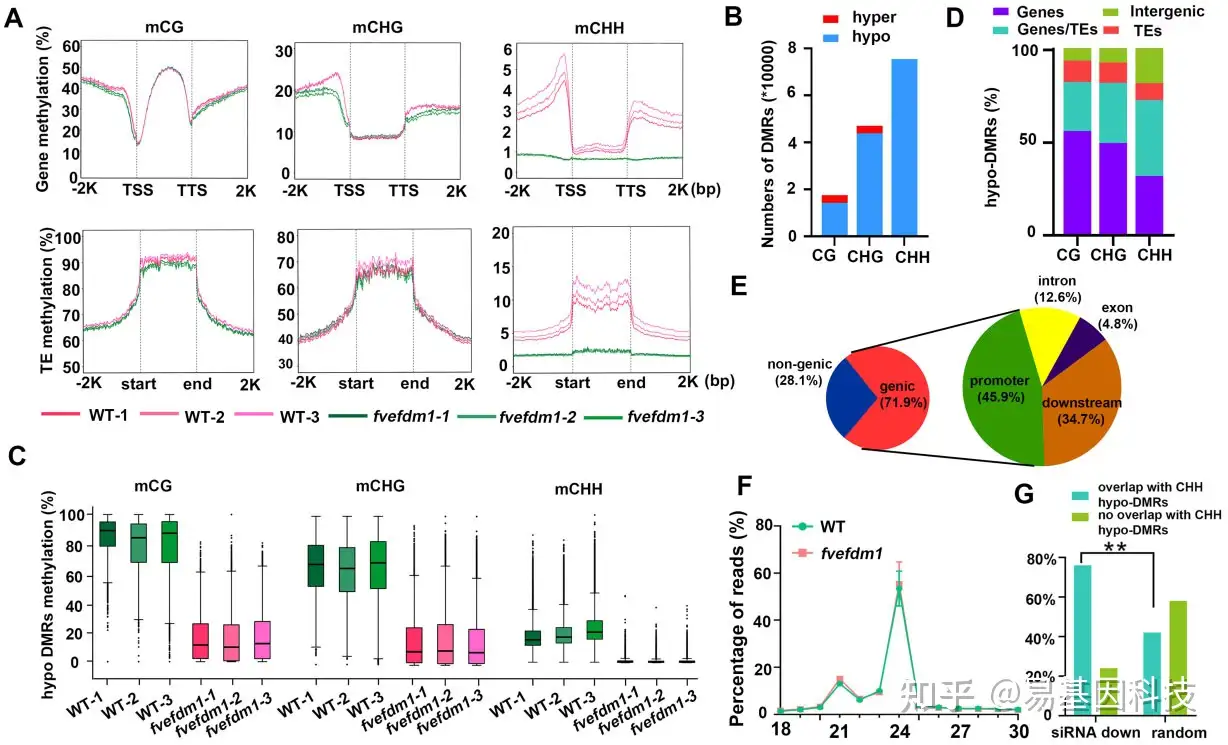
图5:fvefdm1花蕾中的DNA甲基化水平和siRNA丰度。
- F.vesca WT和fvefdm1中所有基因和TE中CG、CHG和CHH甲基化的平均水平,包括转录起始位点(TSS)上游2kb和转录终止位点(TTS)下游2kb。
- fvefdm1中CG、CHG和CHH中相对于WT的hyper-DMR和hypo-DMR数量。
- WT和fvefdm1中hypo-DMR中的CG、CHG和CHH甲基化水平方框图。Center line, median; box limits, upper and lower quartiles; whiskers,1.5 X interquartile range; points, outliers.(A)和(C)设置三个生物学重复。
- CG、CHG和CHH 中hypo-DMR的基因组分布。N(CG-hypo-DMR)=13563,n(CHG-hypo-DMR)=43141,n(CH-hypo-deMR)=74720。
- CHH hypo-DMR在不同基因组区域分布。Promoter表示TSS上游2kb。Downstream表示TTS的下游2kb。
- WT和fvefdm1中与基因组比对的小RNA的大小分布。数据表示为三个生物重复的平均值±SD。
- 下调(downregulated)(n=23395)或随机(random)(n=233 95)siRNA簇与CHH-hypo-DMR重叠或不重叠的百分比。**P<0.01,Fisher精确检验。
(6)FveFDM1突变导致的差异表达基因
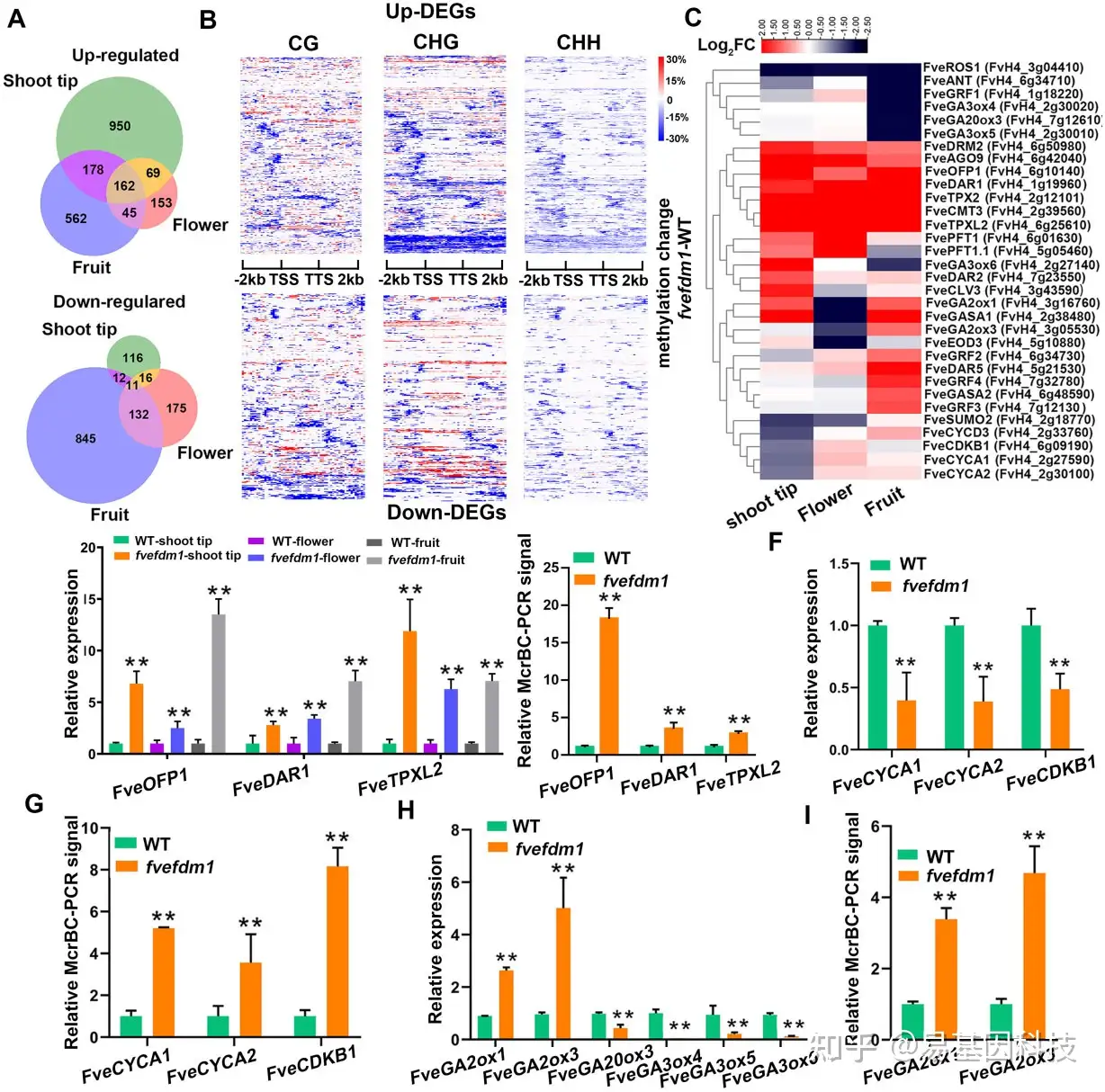
图6:fvefdm1中DNA甲基化导致的DEG变化。
- 与WT相比,fvefdm1的茎尖、花和果实中特异性和共有的差异表达基因(DEG)Venn图(倍数变化>2,P<0.01=。
- 与WT相比,fvefdm1花朵中CG、CHG和CHH环境下DEG的DNA甲基化变化热图(fvefdm1-WT)。
- 在果实器官大小中具有潜在调控作用的候选DEG的log2转化倍数变化热图。
- RT–qPCR检测三种共有上调基因在茎尖、花和果实中的表达水平。
- 幼叶中三个共有上调基因的DNA甲基化水平的McrBC-qPCR分析。
- RT–qPCR检测细胞周期基因在茎尖的表达水平。
- 幼叶细胞周期基因DNA甲基化水平的McrBC-qPCR分析。
- RT-qPCR检测7 DAP时果实中GA生物合成和分解代谢基因的表达水平。
- 7 DAP时果实GA生物合成和分解代谢基因DNA甲基化水平的McrBC-qPCR分析。
在(E、G和I)中,对McrBC消化的基因组DNA进行qPCR,其中高qPCR信号表示较低的mC水平。以GAPDH(FvH4_4g24420)中没有DNA甲基化片段作为对照。(D-I)中的数据从三个生物学重复中获得的平均值±SD;**P<0.01,学生t检验。
(7)FveFDM1介导的RdDM通路与GA和生长素互作
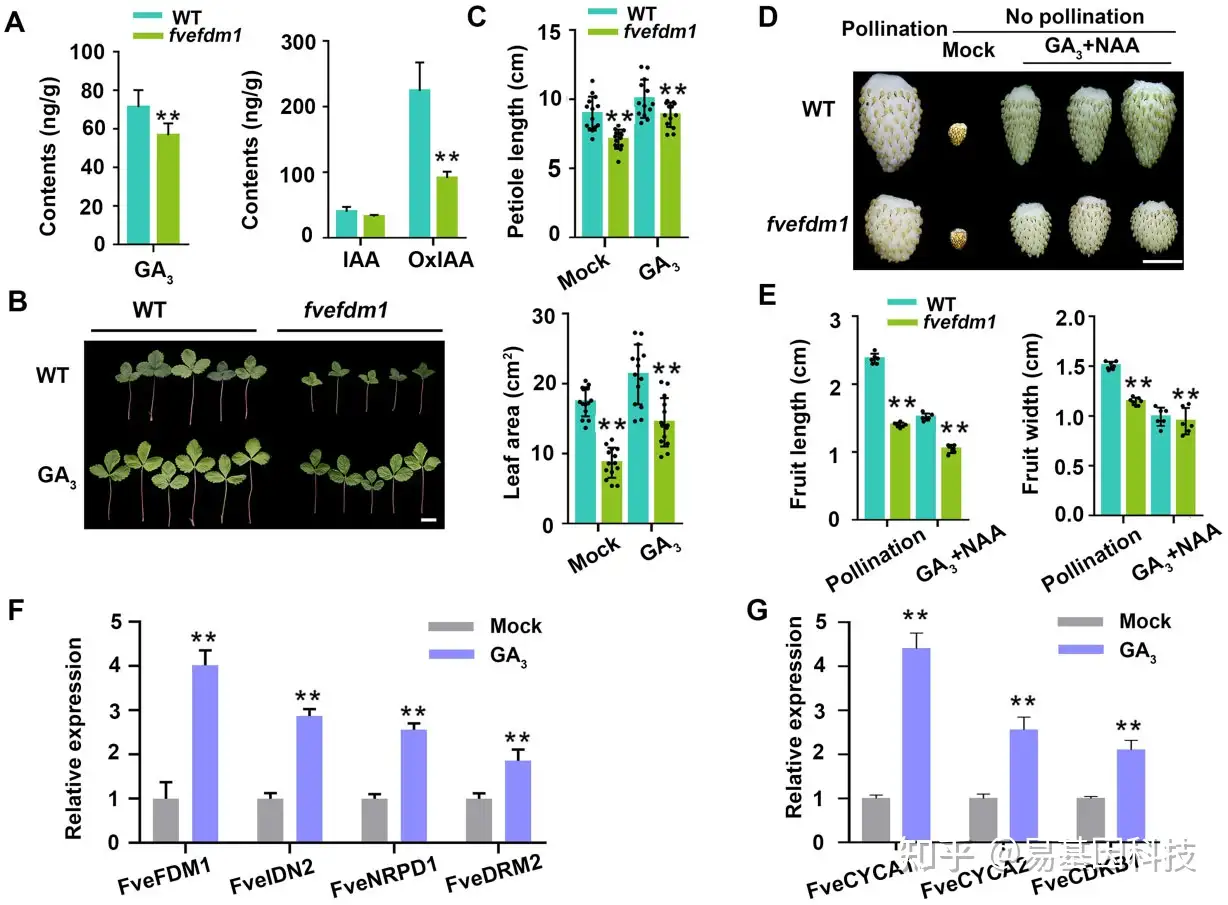
图7:RdDM与GA和生长素互作。
- WT和fvefdm1幼叶中GA和生长素的含量。
- GA 3处理2周后WT和fvefdm1叶片图像。比例尺:1 cm。
- GA 3处理2周后WT和fvefdm1的叶柄长度和叶片面积。
- GA 3 + NAA处理1个月后WT和fvefdm1未授粉果实的图像。比例尺:1cm。在(B)和(D)中,对单个图像进行数字提取以进行比较。
- GA 3 + NAA处理1个月后WT和fvefdm1未授粉果实的宽度和长度。
- GA 3处理24h后WT幼苗中FveFDM1及其他三个RdDM基因的表达水平。
- GA 3处理24 h后WT幼苗细胞周期基因的表达水平。柱状图数据为三个生物学重复的平均值±SD;** P<0.01,学生t检验。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因科技提供全面的DNA甲基化研究整体解决方案。
参考文献:
Zheng G, Hu S, Cheng S, Wang L, Kan L, Wang Z, Xu Q, Liu Z, Kang C. Factor of DNA methylation 1 affects woodland strawberry plant stature and organ size via DNA methylation. Plant Physiol. 2023 Jan 2;191(1):335-351. pii: 6749584.
相关阅读:
科研速递 | WGBS等揭示丹参甲基化表征及DNA甲基化在丹参酮生物合成中的调控机制
科研速递 | 全基因组DNA甲基化测序(WGBS)揭示儿童哮喘增强子区域的整体低甲基化